Abstract
Introduzione
Carne rossa nella dieta ed incidenza del cancro del colon-retto
Possibili sostanze nocive prodotte durante la cottura e la trasformazione dei cibi
Formazione di sostanze nocive in altri alimenti diversi dalla carne rossa
Conclusioni
Conflitto di interessi
Contributi degli autori
Riferimenti
Sun Jin Hur , Yohan Yoon , Cheorun Jo , Jong Youn Jeong e Keun Taik Lee
CRF3-2019-0075 Inviato il 27/3/2019, accettato il 28/8/2019. L’Autore Hur collabora con il Dept. of Animal Science and Technology, Chung-Ang Univ., Anseong, 17546, Corea. L’Autore Yoon collabora con il Dept. of Food and Nutrition, Sookmyung Women’s Univ., Seoul, 04310, Corea. L’Autore Jo collabora con il Dept. of Agricultural Biotechnology, Center for Food and Bioconvergence, e con il Research Inst. of Agriculture and Life Science, Seoul Natl. Univ., Seoul, 08826, Corea. L’Autore Jeong collabora con la School of Food Biotechnology and Nutrition, Kyungsung Univ., Busan, 48434, Corea. L’Autore Lee collabora con il Dept. of Food Processing and Distribution, Gangneung-Wonju Natl. Univ., Gangneung, 25457, Corea. Domande direttamente all’Autore Lee (E-mail: leekt@gwnu.ac.kr). Gli Autori Sun Jin Hur e Yhoan Yoon hanno contribuito in egual misura alla realizzazione di questo manoscritto.
Abstract
Un eccesso di ferro eme viene considerato la causa principale dell’aumento del rischio di cancro legato al consumo di carne rossa. Tuttavia, pesci, crostacei, tè e spezie contengono fino a cinque volte più ferro della carne rossa. Non ci sono prove sufficienti in grado di dimostrare che l’assunzione del ferro contenuto nella carne rossa della dieta sia il principale fattore chiamato in causa per lo sviluppo del cancro del colon-retto. Inoltre, alcune sostanze nocive prodotte durante la preparazione della carne rossa, comprese le ammine eterocicliche (HCA), gli idrocarburi policiclici aromatici (PAH), i composti N-nitrosi e l’acrilammide, sono fattori estrinseci capaci di aumentare la cancerogenicità. Le HCA vengono prodotte durante la cottura di carni rosse, pollame e pesce. Anche i PAH possono essere prodotti durante la cottura di svariati alimenti come latticini, frutta, verdura e cereali. L’assunzione media giornaliera di carne rossa nei Coreani è di 62 grammi; la quantità di PAH che entrano nel corpo tramite la carne rossa ingerita è inferiore alla quantità media di PAH che pervengono al corpo quando è esposto all’aria. Di conseguenza, è difficile concludere che la carne rossa presente nella dieta sia la principale causa di cancro del colon-retto. Piuttosto potrebbe esserci l’influenza di molteplici fattori, come il consumo di frutta e verdura, il consumo di alcol, il fumo, il sovrappeso, l’obesità e lo stress.
Parole chiave: cancro del colon-retto, ammine eterocicliche (HCA), N-nitroso composti (NOC), idrocarburi policiclici aromatici (PAH), carne rossa
Introduzione
Il 26 ottobre 2015, l’International Agency for Research on Cancer (IARC), un’organizzazione affiliata all’Organizzazione Mondiale della Sanità, ha valutato la cancerogenicità correlata al consumo di carni rosse e delle carni trasformate. La carne rossa è stata classificata come probabilmente cancerogena per l’uomo (Gruppo 2A), sulla base di limitate prove causali relative ai tumori nell’uomo e sulla base di solide prove meccanicistiche a sostegno di un effetto cancerogeno. La carne trasformata viene classificata come cancerogena per l’uomo (Gruppo 1), in base a prove sufficientemente valide per poter affermare che il suo consumo causi il cancro del colon-retto. Ciò ha suscitato molte opinioni discordanti da parte dei governi e delle società nei diversi paesi. Ad esempio, la French Agency for Food, Environmental and Occupational Health and Safety (ANSES) sostiene che, poiché il cancro è una malattia complessa, il rischio dovuto all’assunzione di un alimento in particolare, dovrebbe essere valutato considerando in maniera equilibrata i benefici nutrizionali di tale alimento. L’ANSES raccomanda una dieta equilibrata con un apporto moderato dei vari tipi di carne (500 g/settimana) (ANSES, 2015). La Food Safety Authority of Ireland (FSAI) ha reso noto che la carne rossa non dovrebbe essere evitata del tutto, dato che un apporto moderato di carne rossa (circa 100 g/giorno) è fondamentale per una dieta sana (FSAI, 2015). La Food Safety Commission del Giappone ha dichiarato che il report di IARC valutava l’eventuale esistenza del rischio di cancro, associato al consumo di carni rosse e di carni lavorate, senza arrivare a determinare il livello di rischio dovuto alla sua assunzione o senza prevedere l’entità dell’influenza della carne rossa sulla salute umana (Food Safety Commission del Giappone, 2015). Il report IARC/Organizzazione Mondiale della Sanità del 2015 ha delineato una correlazione tra il consumo di carne rossa e di carne lavorata e l’incidenza del cancro utilizzando le meta-analisi. Chan et al. (2011), nelle loro meta-analisi, hanno esaminato 28 studi di coorte riguardanti la carne rossa e i prodotti trasformati a base di carne. I risultati indicavano che un’assunzione giornaliera di 100 g di carne rossa aumentava il rischio di cancro del colon-retto del 17% e con un’assunzione supplementare di 50 g di carne lavorata il rischio aumentava del 18%. I 28 studi comprendevano tre studi di coorte condotti su individui della regione Asia-Pacifico. Questi tre studi sono stati analizzati separatamente e il rischio relativo riguardante il consumo di carne rossa era di 1.01 (intervallo di confidenza del 95% da 0.69 a 1.48). Ciò potrebbe essere interpretato come un aumento del rischio di cancro del colon-retto solamente dell’1% in seguito ad un consumo giornaliero di 100 g di carne rossa; inoltre, il risultato non è apparso statisticamente significativo. In linea generale i dati raccolti evidenziano i limiti dell’applicazione dei risultati del report IARC alla popolazione coreana (Hur, Jo, Yoon, Jeong, & Lee, 2019). La maggior parte degli studi inclusi erano studi di coorte che coinvolgevano individui provenienti dai paesi occidentali. I dati ottenuti sugli individui della regione Asia-Pacifico sono meno solidi e non è stata ancora verificata l’esistenza di una correlazione tra la carne rossa/lavorata della dieta e il rischio di cancro colorettale nella popolazione. Un singolo fattore specifico, come il consumo di carne rossa, non dovrebbe essere considerato la causa principale di un aumento del rischio di cancro del colon-retto. Piuttosto, l’induzione del cancro colorettale sarebbe maggiormente correlata ad una miriade di fattori complessi che includono età, fattori genetici, abitudini alimentari, ambiente e stile di vita. La relativa mancanza di studi di coorte eseguiti su individui provenienti dalla Corea e dall’Asia implica la poca attendibilità dell’applicazione dei risultati sugli occidentali agli individui asiatici. Un’incidenza relativamente maggiore di cancro colorettale è stata segnalata tra i coreani piuttosto che tra le persone provenienti dai paesi occidentali, sebbene il consumo di carne rossa o di prodotti a base di carne lavorata risulti essere minore in Corea (Lee et al., 2017). Il risultato potrebbe essere stato influenzato da altri fattori, come l’elevato consumo di alcol, la percentuale di sigarette fumate, il livello di stress e il consumo di sale (Boada, Hernandez, & Luzardo, 2016; Hur et al., 2019). Pertanto, è necessario uno studio epidemiologico per individuare la correlazione tra tali fattori e l’incidenza del cancro del colon-retto, così come dati più oggettivi e accurati sulla sicurezza della carne rossa. Il presente studio è stato condotto per identificare la causa principale del cancro del colon-retto (allo scopo di fornire dati fondamentali utili per la sua prevenzione), andando ad analizzare i diversi fattori che influenzano la patogenesi di questo tumore rispetto all’assunzione di carne rossa in particolare e del cibo in generale.
Carne rossa nella dieta ed incidenza del cancro del colon-retto
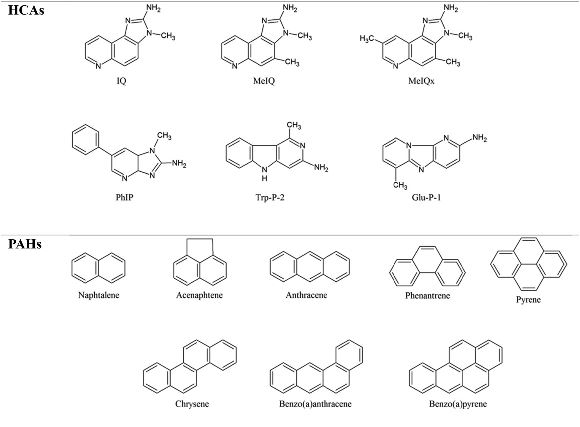
Questo studio ha preso in esame la correlazione esistente tra la carne rossa assunta con la dieta e la patogenesi del cancro colorettale, raccogliendo e analizzando gli ultimi dati accademici e i dati statistici sistematici relativi alla sicurezza del consumo di carne rossa pubblicati dal marzo 2016. Come fattore intrinseco di cancerogenicità della carne rossa nella dieta, va considerata l’eccessiva assunzione di ferro eme. Il meccanismo tramite il quale l’assunzione di ferro eme presente nella carne rossa aumenterebbe il rischio di cancro colorettale, rimane poco chiaro. Tuttavia, sono state suggerite due cause principali. Una prevede l’aumento, in seguito al sovraccarico di ferro eme, della produzione di N-nitroso composti cancerogeni (NOC). L’altra causa sarebbe il danno al DNA causato dai prodotti della perossidazione lipidica (Robbiano, Mereto, Corbu, & Brambilla, 1996). Il contenuto di ferro nella carne rossa varia a seconda della specie animale esaminata. In base ai grammi, la carne suina contiene 1.2 mg di ferro (0.0012%), la carne bovina ne contiene 3.2 mg (0.0032%) e l’agnello ne contiene 2.0 mg (0.002%).La carne di maiale è la principale materia prima utilizzata per la produzione di carne trasformata (Rural Development Administration – National Institute of Agricultural Sciences [RDA-NIAS], 2011). Tuttavia, il contenuto di ferro nella carne suina è nettamente inferiore rispetto a quello che si ritrova in altre tipologie di carne rossa. Inoltre, va sottolineato che pesci e crostacei, tè e spezie contengono da tre a cinque volte più ferro della carne rossa (RDA-NIAS, 2011). Pertanto, le prove disponibili sembrano insufficienti per sostenere come la carne rossa, così come la carne di maiale, siano la principale causa di cancro del colon-retto a causa del loro contenuto di ferro, appunto perché anche altri alimenti (diversi dalla carne rossa) ne contengono notevoli quantità. Un fattore estrinseco del rischio cancerogeno della carne assunta con la dieta è costituito dalle sostanze nocive che possono prodursi durante la cottura. Tra queste sostanze includiamo le ammine eterocicliche (HCA), gli idrocarburi policiclici aromatici (PAH), gli N-nitroso composti e l’acrilammide (AA) (Figura 1). Le HCA hanno un potenziale cancerogeno anche nell’ordine di milligrammi. Tuttavia, la quantità di HCA prodotte durante la cottura della carne è di nanogrammi (Bogen, 1994). Pertanto, si presume che il potenziale cancerogeno delle HCA prodotte durante la cottura della carne rossa sia relativamente basso. Le HCA sono prodotte anche durante la cottura della carne di pollame e del pesce. Anche i PAH possono venire prodotti durante la cottura di diversi alimenti come latticini, frutta, verdura e cereali. Il consumo medio giornaliero di carne rossa da parte dei Coreani è di 62 g (Korea Centers for Disease Control & Prevention, 2016). Quindi, per tali individui, la quantità di PAH che entrano nel corpo mediante la carne rossa (4.52 μg/kg) è inferiore alla quantità media di PAH a cui il corpo viene esposto in seguito all’inalazione dell’aria (2.7 μg/kg) (Menzie, Potocki, & Santodonato, 1992). Diversi studi (Chiavarini, Bertarelli, Minelli, & Fabiani, 2017; Cross & Sinha, 2004; Zheng & Lee, 2009) riportano come l’assunzione di HCA o di PAH sia correlata alla comparsa del cancro colorettale. Contrariamente, Le et al. (2016), nel corso di un follow-up della durata di 14 anni del Nurses’ Health Study e dell’Health Professional follow-up study cohorts, hanno concluso che l’assunzione di mutageni della carne (HCA) non fosse significativamente correlata al rischio di sviluppare il cancro del colon-retto. Come già accennato in questo articolo, concordiamo che, a causa delle differenti vie di assunzione di HCA e PAH, saranno necessarie ulteriori indagini su fattori complessi invece di trarre conclusioni semplicemente sul fatto che l’assunzione di sostanze come HCA e PAH sia l’unica causa di cancro colorettale.
Figura 1- Struttura chimica di alcune sostanze nocive che si formano durante la lavorazione della carne rossa.
L’analisi di articoli accademici e dei dati di ricerca relativi alle sostanze nocive prodotte durante la cottura delle carni, ha indicato come le diverse condizioni e metodiche di cottura potrebbero ridurre la produzione di sostanze nocive (Meurillon & Engel, 2016; Singh, Varshney, & Agarwal, 2016). Questi includono:
- Abbassamento della temperatura e riduzione dei tempi di cottura;
- Pretrattamento al microonde per evitare una cottura prolungata della carne;
- Durante la cottura alla griglia, impedire il contatto diretto della carne con la fonte di calore così come il contatto con il fumo;
- Evitare di mangiare il fondo di cottura e i residui rimasti sulla pentola prodotti durante la cottura;
- Durante la cottura, aggiungere aceto o marinate a base di condimenti naturali, spezie e antiossidanti, e
- Rimuovere l’involucro delle salsicce affumicate prima di consumarle.
La maggiore incidenza del cancro del colon-retto nella popolazione coreana è stata di 45 per 100.000 individui nel 2012 (Ferlay et al., 2013). Tuttavia, Shin, Jung,Woo e Jeong (2016) hanno sottolineato che il risultato si basava su dati raccolti fino al 2009 che sono stati poi stimati per il 2012; quando sono stati raccolti e rivalutati i dati dal 2008 al 2012, l’incidenza del cancro colorettale in Corea nel 2012 (per 100.000 individui, tassi di incidenza ad età standard) è stata di 37.3, inferiore rispetto a quella del Giappone (38.4), dei Paesi Bassi (38.5), dell’Australia. (43.2) e della Nuova Zelanda (43.5). Nel 2013 in Corea il consumo annuo di carne era di 63.61 kg, pari alla metà o ai due terzi dei livelli di consumo della maggior parte dei paesi occidentali (Food and Agriculture Organization [FAO], 2016). È quindi difficile affermare l’esistenza di una correlazione tra l’incidenza del cancro colorettale in Corea e l’assunzione di carne totale o di carne rossa. Analizzando i dati statistici riguardanti (oltre l’assunzione di carne rossa) il consumo di frutta e verdura, di alcol, di sigarette, il rapporto tra sovrappeso e obesità e l’aspettativa di vita, si è evidenziata una certa difficoltà nello stabilire un singolo fattore specifico come causa del cancro del colon-retto. Surya et al. (2016) hanno suggerito che le prove a sostegno di come l’assunzione di carne rossa e l’adozione di una dieta ricca di ferro-eme siano in grado di aumentare l’incidenza del cancro colorettale, si basino sul ruolo che la carne rossa e l’eme presente negli alimenti svolgono nella selezione positiva delle cellule preneoplastiche. Da Silva, Wernhoff, Dominguez-Barrera e Dominguez-Valentin (2016) hanno spiegato che un potenziale meccanismo per l’aumento della cancerogenicità correlata al consumo di carne rossa, potrebbe essere dovuto all’attività simile alla lectina dell’anticorpo umano anti-Neu5Gc. Tuttavia, Alisson–Silva, Kawanishi e Varki (2016) hanno riferito che il consumo di carne rossa non può essere individuato come causa di alcuna malattia, nonostante i vari effetti che questo alimento potrebbe avere sulla comparsa di esse, favorendo l’assunzione di grassi saturi, l’elevato apporto di sale, la produzione microbica di ossido di trimetilammina e dei contaminanti ambientali della carne rossa. Demeyer, Mertens, De Smet e Ulens (2016) hanno riferito che, per quanto i PAH e le HCA cancerogene influenzino fortemente lo sviluppo del cancro colorettale, un elevato consumo di carne rossa in una dieta non equilibrata potrebbe promuovere diversi stadi di sviluppo del cancro del colon-retto. Non è stato ancora identificato alcun meccanismo che possa spiegare perfettamente le ipotesi relative all’incidenza del cancro colorettale in seguito all’assunzione di carne rossa e di carne lavorata. Turney e Lloyd (2017) hanno riferito che, nonostante il ruolo centrale del ferro-eme o delle HCA nel correlare il consumo di carne rossa con la cancerogenicità, la quantità di sostanze nocive tenute in considerazione nella maggior parte degli studi superava di molto la soglia riscontrata nella dieta umana. Gli autori hanno dichiarato una mancanza di prove sufficienti utili per dimostrare l’esistenza di una correlazione tra il rischio di cancro colorettale e l’assunzione di carne rossa, alimento che ad oggi fa parte di un modello alimentare sano. Gli autori hanno anche sottolineato che gli esperimenti finora condotti utilizzavano quantità eccessive di sostanze nocive rispetto all’effettivo quantitativo presente nella dieta e che le tipologie di tali studi non erano adatte a valutare il potere cancerogeno legato all’assunzione di carne rossa negli uomini. Così, appaiono necessari nuovi esperimenti per considerare l’effettiva assunzione. Jun, Ha, Chung e Joung (2016) hanno analizzato gli effetti del consumo di carne e di latte in Corea, dove la dieta è basata principalmente sul riso. Gli autori hanno riferito che la correlazione tra il cancro e l’assunzione di carne e di latte variava a seconda della tipologia di cancro, e come correlazione non era forte né in Corea né negli altri paesi asiatici. Yang et al. (2016) hanno condotto uno studio prospettico su individui sottoposti ad un checkup della salute che coinvolgeva anche il colon presso il Seoul Natl. Univ. Hospital. I risultati indicavano la mancanza di una correlazione significativa tra l’assunzione di grassi alimentari e l’adenoma del colon-retto. Gli autori hanno riportato anche l’assenza di una correlazione significativa tra la prevalenza dell’adenoma colorettale (tumore benigno) e l’apporto energetico totale, il consumo di grassi animali e vegetali e l’assunzione di proteine totali di origine animale e vegetale. Bellavia, Stilling e Wolk (2016) hanno riferito che, sia nei gruppi ad elevato e in quelli a basso consumo di carne rossa, il rischio di mortalità per cancro non era correlato al suo consumo. Per Ekmekcioglu et al. (2018) sarebbe consigliabile una riduzione del consumo di carne presente nella dieta, perché l’attuale livello di assunzione è troppo elevato, sebbene essa abbia comunque molti benefici dal punto di vista nutrizionale. Sobiecki, Appleby, Bradbury e Key (2016) hanno sottolineato la necessità di assumere alimenti con elevato valore nutrizionale; anche se l’elevato contenuto di fibre e di acidi grassi benefici di una dieta vegetariana potrebbe fornire protezione contro i disturbi cardiaci, potrebbe portare anche ad alcuni squilibri nutrizionali, soprattutto per quanto riguarda l’assunzione di vitamina B12, zinco, selenio e iodio. A proposito della la relazione dell’IARC che affermava: “il consumo di carne rossa e di carne lavorata aumenta il rischio di cancro colorettale”, Klurfeld (2016) sosteneva che i dati utilizzati dall’IARC per trarre questa conclusione fossero limitati, vista la mancanza di prove di una correlazione causa-effetto, e che la sperimentazione condotta sugli animali non forniva prove a sostegno dei dati epidemiologici. Gli autori hanno inoltre affermato che il questionario sulla frequenza di assunzione dell’alimento, utilizzato per stimare il consumo di carne nello studio IARC, non poteva misurare con precisione la quantità di proteine consumate e che i dati convalidati erano comunque insufficienti per classificare la carne rossa o la carne lavorata come cancerogena. Demeyer et al. (2016) riportavano di un’incertezza relativa ai fattori coinvolti nell’incidenza del cancro colorettale ed hanno suggerito la necessità di identificare un nuovo meccanismo o di rivedere la teoria convenzionale che non spiega chiaramente la correlazione tra il consumo di carne lavorata e di carne rossa e il rischio di cancro del colon-retto. Vineis e Stewart (2016) hanno sottolineato che il report sull’obesità e il consumo di carne lavorata come causa di cancro negli esseri umani ha creato una certa confusione; secondo la loro opinione la comparsa del cancro è influenzata da varie cause e il solo essere obesi, o il mangiare carne rossa, non indica un aumento del rischio di comparsa del cancro. Gli autori hanno anche riportato che l’incidenza del cancro colorettale negli individui che mangiavano frequentemente carne rossa era del 5%, mentre il tasso degli individui con un consumo medio era del 6%. Inoltre hanno spiegato che, sebbene un’ulteriore assunzione giornaliera di 50 g di carne lavorata aumentasse l’incidenza del cancro colorettale del 18% circa, l’aumento assoluto da loro osservato era basso. L’opinione pubblica e i media dovrebbero inoltre saper riconoscere accuratamente la differenza che intercorre tra “grado di evidenza” e “forza dell’aumento del rischio”. Il report di IARC avrebbe potuto fare una distinzione più accurata tra i termini “ncancerogeo” e “causa del cancro”. I risultati dei numerosi studi condotti finora non hanno fatto buona chiarezza sulla correlazione esistente tra carne rossa e cancro colorettale ed hanno generato notevoli controversie. A livello globale,la percentuale di individui anziani è in aumento, cosa che riflette i progressi nelle terapie mediche e farmacologiche, nonché il miglioramento della qualità della vita. Tra tutti i fattori legati allo stile di vita, un buono stato nutrizionale è un elemento cruciale per mantenere una buona salute. Mentre la carne rossa presente nella dieta e i prodotti ottenuti dalla sua lavorazione sono indispensabili per l’assunzione dei vari nutrienti, le prove scientifiche riguardo il loro valore salutistico restano discutibili. In ultima analisi, è consigliabile considerare questo aspetto come un problema legato alla quantità e alle modalità di assunzione. Nonostante il minor consumo di carne (63.61 kg pro capite nel 2013), la Corea ha un’incidenza di cancro colorettale paragonabile a quella della Danimarca e dei Paesi Bassi. Inoltre, se confrontato con quello dell’Australia e della Nuova Zelanda, la percentuale del consumo di carne in Corea è stata, rispettivamente, del 54.7% e del 62.7% (FAO, 2016). Pertanto, si pensa che in Corea il consumo di carne totale e quello di carne rossa (bovina e suina) e l’incidenza del cancro colorettale non siano correlati. Inoltre, dati più recenti riportano come il consumo coreano annuale di 172.38 kg di verdura pro capite sia notevolmente superiore rispetto a quello degli altri paesi esaminati (FAO, 2016). Nel 2014, il consumo medio di alcol tra i coreani di età superiore ai 15 anni è stato di 9.0 l, simile a quello della Danimarca e dei Paesi Bassi e il numero medio di sigarette fumate è stato di 14.7 al giorno, situazione analoga a quella della maggior parte degli altri paesi inclusi nell’indagine (OECD, 2015). Inoltre, la percentuale di persone in sovrappeso ed obese rispetto a quelle con BMI normale era più bassa in Corea che negli altri paesi occidentali ( OECD Health Statistics, 2016). Nel complesso, rispetto ad altri paesi con un’elevata incidenza di cancro colorettale, in Corea il consumo di carne è relativamente basso, quello di pesce e verdura è più elevato e il rapporto tra individui in sovrappeso/obesi e individui con normale BMI è basso. Pertanto, l’affermazione che il consumo di carne rossa inneschi cambiamenti fisiologici e cancerogeni che determinerebbero la patogenesi del cancro colorettale, è ad oggi discutibile. Sebbene l’eccesso di ferro possa indurre stress ossidativo, il contenuto di ferro nella carne suina è basso quanto quello della carne di pollame e del pesce. Inoltre, le diverse sostanze bioattive presenti negli ortaggi, che sono molto consumati in Corea, potrebbero arrestare la perossidazione lipidica mediata dal ferro. Di conseguenza, una dieta ricca di verdure contribuirebbe probabilmente alla prevenzione del cancro. Inoltre, sebbene la cottura della carne produca varie sostanze nocive che generano preoccupazione nei consumatori, i livelli di tali sostanze sono dell’ordine di nanogrammi, quindi estremamente bassi. Va anche detto che tali sostanze possono essere ulteriormente ridotte in diversi modi. Da notare il fatto che anche cucinando altri alimenti diversi dalla carne si possono produrre comunque delle sostanze nocive. Poiché lo sviluppo del cancro è influenzato da molteplici fattori, il solo consumo di carne rossa non dovrebbe essere direttamente correlato alla sua comparsa (Vineis & Stewart, 2016). Mutageni della carne, inclusi HCA, PAH e NOC, possono essere coinvolti nella comparsa del cancro del colon-retto, a seconda della loro attivazione o detossificazione effettuata dagli enzimi metabolizzanti gli xenobiotici di fase I e II (XME) presenti nel fegato e nel colon (Gilsing et al., 2012; Wang et al., 2012). I polimorfismi a singolo nucleotide (SNP) nei geni codificanti questi XME possono modificare la capacità di attivazione o detossificazione degli agenti cancerogeni (Gilsing et al., 2012). Questi enzimi variano, per quanto riguarda la loro attività metabolica, nella popolazione umana; è quindi biologicamente plausibile che l’eredità di specifiche varianti alleliche dei geni metabolizzanti possa influenzare il rischio di comparsa del cancro colorettale. (Wang et al., 2012).
Assunzione di ferro ed incidenza del cancro del colon-retto
Nel corpo umano il ferro è presente in quantità minima; tuttavia, è un minerale assolutamente essenziale per le attività metaboliche dell’uomo e come componente dell’emoglobina che fornisce ossigeno a tutto il corpo. Il ferro favorisce anche la proliferazione e la crescita cellulare, partecipando direttamente al ciclo redox. Può quindi essere considerato un minerale essenziale per la sopravvivenza cellulare (Torti & Torti, 2013). D’altra parte, un sovraccarico di ferro può causare disfunzioni nel suo metabolismo, qualora gli ioni Fe2+ presenti nel citoplasma favoriscano la produzione di specie reattive dell’ossigeno che inducono stress ossidativo e citotossicità che possono portare ad un aumento del rischio di comparsa del cancro. Il ferro libero bivalente altamente reattivo andrebbe incontro alla reazione di Fenton con il perossido di idrogeno, producendo radicali idrossilici che hanno una tossicità decisamente maggiore. Questo causa danni al DNA e perossidazione lipidica (Huang, 2003). Pertanto, è importante conoscere il contenuto di ferro degli alimenti fonti principali di questo minerale e le sue attività fisiologiche. Apparentemente l’eme è il responsabile della produzione dei NOC endogeni totali nel tratto gastrointestinale e favorisce la perossidazione lipidica. Di conseguenza, si è ipotizzato che l’eme sia un fattore in grado di incrementare il rischio di cancro del colon-retto (Bastide, Pierre, & Corpet, 2011; Czerwonka & Tokarz, 2017). Contemporaneamente si è visto che i sali di calcio, la clorofilla, la vitamina C e vari polifenoli (Mirvish, 1986; Ross & Kasum, 2002), così come un adeguato confezionamento e una corretta conservazione degli alimenti, sarebbero fattori in grado di sopprimere gli effetti nocivi dell’eme (Santarelli, Pierre, & Corpet, 2008). Lo stress ossidativo esercita una potenziale influenza sulla correlazione esistente tra l’incidenza del cancro colorettale e il consumo di carne rossa e di carne lavorata, e il ferro presente nella carne della dieta è considerato il principale responsabile dello stress ossidativo (Toyokuni, 1996). Il ferro si trova in vari alimenti sotto forma di ferro eme o di ferro non eme. Il ferro eme è la forma in cui l’atomo di ferro è legato al gruppo eme. È abbondante negli alimenti di origine animale. Poiché il ferro-eme ha una maggior biodisponibilità rispetto al ferro non eme, gli alimenti di origine animale sono considerati una fonte essenziale di ferro. Gli alimenti di origine vegetale, che contengono principalmente ferro non eme, sono un’altra importante fonte di ferro (HealthLinkBC, 2017). Nei paesi più sviluppati, la carne rossa è la fonte principale di ferro alimentare e il contenuto di ferro varia a seconda della tipologia e della porzione di carne. La carne di suino contiene da 0.5 a 1.2 mg di ferro/100 g e la carne bovina contiene da 1.4 a 2.9 mg di ferro/100 g (U.S. Dept. of Agriculture [USDA], 2015). La maggior parte del contenuto totale di ferro (dal 40% al 90%) nella carne rossa è costituito da ferro-eme (Czerwonka & Tokarz, 2017). Nella carne della dieta, il ferro-eme rappresenta il 70% del contenuto totale di ferro, e la carne bovina ha un contenuto di ferro maggiore rispetto alla carne suina (USDA, 2015). Il contenuto di ferro nella carne assunta con la dieta può essere modificato a seconda del metodo di cottura. Dato che il ferro presente in questa carne è racchiuso all’interno di una struttura proteica, in seguito alla cottura e al riscaldamento della carne il contenuto di ferro aumenta del 10% – 40% circa (Czerwonka & Tokarz, 2017; USDA, 2015). Come si è visto la carne rossa è un’ottima fonte alimentare di ferro, ma anche altri cibi come pesce, cereali, fagioli, uova e verdure di colore verde scuro forniscono elevate quantità di ferro (European Food Safety Authority, 2015; Tapiero, Gaté, & Tew, 2001). La percentuale di ferro-eme rispetto all’assunzione di ferro totale va dal 10% al 15% nei paesi più avanzati, che è un livello di gran lunga molto più basso rispetto a quello del ferro non-eme. Anche l’assunzione di ferro con alimenti diversi dalla carne è piuttosto elevata visto che il 50% circa del ferro assorbito proviene dalla porfirina (Hunt, 2003; Jiang et al., 2004).
Possibili sostanze nocive prodotte durante la cottura e la trasformazione dei cibi
Le sostanze nocive che possono essere prodotte durante la cottura della carne includono generalmente HCA, PAH, NOC e AA.
HCA
Le HCA (ammine eterocicliche) sono composti potenzialmente mutageni prodotti durante la cottura degli alimenti. Derivano in larga parte da alimenti proteici, come carne e pesce, cotti a temperature comprese tra i 150 e 300°C. Le HCA vengono classificate principalmente in HCA imidazo-quinoline (2-ammino-3-metilimidazo[4,5-f]chinolina) tipo-IQ e in HCA non-IQ o aminocarboline. Le HCA tipo-IQ si formano dal calore generato dalla reazione di Maillard che coinvolge creatina (o creatinina), aminoacidi e zuccheri (Gibis, 2016). La reazione si verifica quando gli alimenti vengono cotti a temperature comprese tra 150 e 300°C. Le HCA non IQ solitamente si formano dalla pirolisi di amminoacidi e proteine ad elevate temperature, sopra i 300°C (Gibis, 2016).
PAH
I PAH comprendono più di 250 specie note. Tra queste, 15 possiedono un potere mutageno e cancerogeno. L’UE Scientific Committee on Food ha definito 15 specie di PAH, tra cui il benzo[α]pirene (BaP) è il più noto. Dal 2002, il BaP viene utilizzato come indicatore della presenza dei PAH cancerogeni negli alimenti (European Commission Scientific Committee on Food, 2002). I PAH generati durante la cottura tendono a distribuirsi sulla superficie degli alimenti. Possono essere presenti naturalmente su frutta e verdura, poiché le particelle sospese nell’aria possono ricadere sulla loro superficie. Rispetto alle verdure fresche, quelle grigliate contengono un livello maggiore di PAH cancerogeni. I PAH sono presenti anche nel pesce, nella carne, nei latticini, nei grassi e negli oli vegetali. L’impiego di particolari metodi di cottura, come la cottura alla griglia, l’arrostimento e la frittura, nonché di metodi di lavorazione come l’affumicatura e l’essiccazione, sono tra i principali fattori che contribuiscono alla produzione di PAH dagli alimenti, e sono influenzati anche dal contenuto di grassi della carne e dal tempo e dalla temperatura di cottura.
NOC
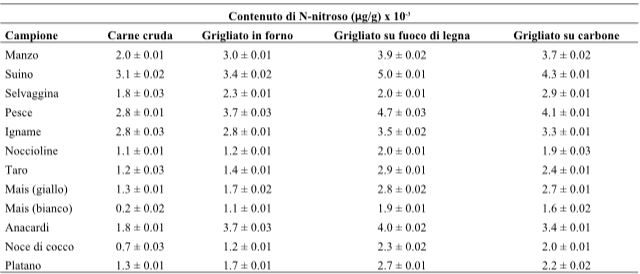
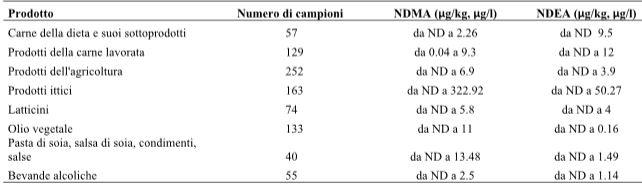
I NOC sono costituiti da nitrosammina [R1N(NO)R2] e nitrosamide [R1N(NO)COR2]. Le nitrosammine includono le dialchilnitrosammine come l’N-nitrosodimetilammina (NDMA), e le nitrosammine cicliche come l’N-nitrosopirrolidina. La nitrosammina è cancerogena quando attivata da un isoenzima del citocromo P450 che catalizza l’inserimento di un gruppo idrossile all’atomo di carbonio più vicino al gruppo N-nitroso (NNO). Il gruppo idrossialchilico in questo prodotto si separa per idrolisi, e il risultante catione alchildiazonio media l’alchilazione delle basi del DNA causando mutazioni e, infine, il cancro. Tali sostanze si formano quando si verificano reazioni tra fattori che provocano la nitrificazione (nitrati, nitriti e composti azotati) aggiunti agli alimenti come conservanti; ammine primarie, secondarie e terziarie; ammidi; proteine; peptidi e aminoacidi durante i processi di lavorazione e di conservazione. Solitamente i NOC si accumulano in alimenti che sono stati conservati per lungo tempo a temperatura ambiente o in alimenti fermentati (Mirvish, 1986). Poiché l’eme è il responsabile della produzione dei NOC totali nel tratto gastrointestinale, potrebbe contribuire ad aumentare il rischio di comparsa del cancro colorettale. Come mostrato nella Tabella 11, la concentrazione dei NOC nella carne di manzo, di maiale e di pesce cotti variava tra i 1.8 e i 5.0 μg/g e, confrontando i vari metodi di cottura, si è visto che la concentrazione maggiore si aveva dopo cottura sul barbecue a legna. Park, Seo, Lee e Kwon (2015) hanno riportato che le concentrazioni di NDMA nelle carni lavorate, come salsicce, prosciutti e pancetta, variavano da 0.31 a 1.54 μg/kg, una concentrazione inferiore rispetto a quella riscontrata in frutta e verdura.
Produzione di sostanze nocive in base alle condizioni di cottura
Il quantitativo di sostanze nocive prodotte durante la cottura della carne può variare a seconda di differenti aspetti come la temperatura, i tempi e i metodi di cottura.
Tempi e temperature di cottura
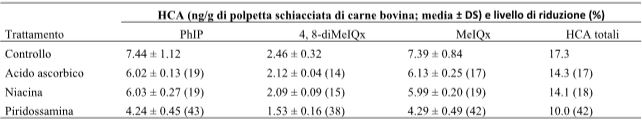
Con l’aumentare della temperatura e con il prolungamento dei tempi di cottura, la quantità di sostanze nocive prodotte dalla carne aumenta. Liao, Xu e Zhou (2009) hanno descritto che le HCA non vengono riscontrate nella carne di maiale non cotta, ma si formano quando viene saltata ad elevate temperature e con una piccola quantità di olio, e questa formazione di HCA aumenta all’aumentare della temperatura di cottura. Altri hanno riferito che, sebbene le HCA non vengano rilevate del tutto (o solo in una quantità molto piccola) nella carne grigliata a 150°C, la loro formazione aumenta quando la temperatura di cottura viene portata a 175, 200 e 225°C (Skog, Steineck, Augustsson, & Jägerstad, 1995). Quando la braciola di maiale, la pancetta, il bacon, la fettina e la carne macinata di bovino venivano cotte rispettivamente a 150, 175, 200 e 225 °C, la quantità di HCA prodotta da ciascun campione di carne è aumentata all’aumentare della temperatura (Tabella 1). Un aumento particolarmente marcato delle HCA si è verificato durante la cottura della carne alla griglia ad una temperatura elevata di 225°C. Sebbene non siano state rilevate HCA (MeIOx, DiMeIOx e PhIP) quando la costoletta e la pancetta di maiale sono state riscaldate a 150°C, i loro livelli di PhIP sono saliti, rispettivamente, a 4.8 e 12.4 ng/g, quando sono state riscaldate a 225°C. Analogamente, quando la pancetta è stata riscaldata a 225°C, i livelli di MeIQx sono saliti da 0 a 23.7 ng/g (Skog et al., 1995). Gibis (2016) ha analizzato la quantità di HCA prodotte da fette di pancetta fritte in padella per 3, 4, 5 e 6 minuti a 150-170 °C, e per 2-3 minuti a 200-220°C. Più alta è la temperatura e più lungo è il tempo di cottura, maggiore è la produzione di HCA. Aygun e Kabadayi (2005) hanno studiato la produzione di BaP provenienti dalla carne rossa cucinando carne di manzo e di agnello a fuoco diretto e ad elevata temperatura per 6 minuti (grigliata) e per 8-9 minuti (ben grigliata). Rispetto alla carne di manzo e di agnello cotta sulla griglia per 6 minuti, quella cotta per 8-9 minuti ha evidenziato una maggiore produzione di BaP (Tabella 2).
Tabella 1- Produzione di ammine eterocicliche in base al tipo di carne, alla temperatura e al tempo di cottura.
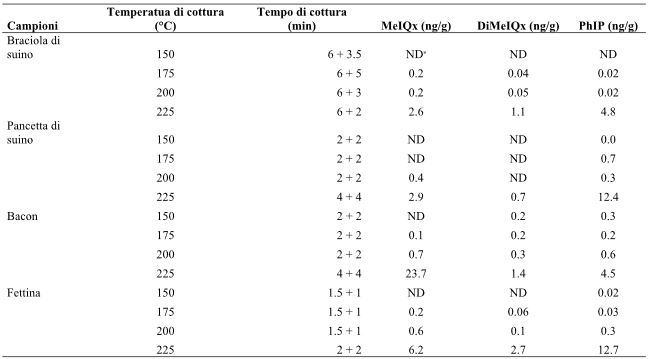
Note: modificata dallo studio originale (Skog et al., 1995). MeIQx: 2-amino-3,8-dimetilimidazol[4,5-f]quinossalina; DiMeIQx: 2-amino-3,4,8-trimetil-imidazol[4,5-f]quinossalina; PhIP: 2-amino-1-metil-6-fenilimidazo[4,5-b]piridina.

Note: modificata dallo studio originale (Aygun & Kabadayi, 2005). I risultati sono presentati come μg/kg ± relativa DS.
Tabella 3- Produzione di HCA da polpette schiacciate di suino a seconda del metodo, della temperatura e del tempo di cottura e della temperatura al cuore.
Tabella 4 – Produzione di benzopirene dalla pancetta grigliata a seconda del metodo e dell’utensile impiegato per la cottura.
Tabella 5 – Produzione di HCA da polpette schiacciate di manzo grigliate in base all’aggiunta di vitamine (0.2 mmol).
Metodi di cottura
Anche l’impiego di differenti metodi di cottura può andare a modificare la quantità di sostanze nocive prodotte dalla carne. In uno studio condotto per confrontare la produzione di HCA totali, quando la carne bovina veniva cucinata secondo tre differenti metodi (sottovuoto, bollita e fritta in padella) la rispettiva produzione di HCA totali era da 0.036 a 0.123, 0.032 e da 0.252 a 0.940 ng/g. Un aumento significativo c’è stato dopo la frittura in padella (Oz & Zikirow, 2015). I risultati dei quantitativi di HCA per le polpette schiacciate di maiale cotte a temperature e con metodi diversi (Tabella 3) hanno rivelato che la bollitura era la tipologia di cottura che ha prodotto il minor quantitativo di HCA totali (Puangsombat, Gadgil, Houser, Hunt, & Smith, 2012; Shin, 2005). La maggior parte delle sostanze mutagene si sono prodotte durante la cottura della carne rossa utilizzando calore a temperature comprese tra i 120° e 230°C. I metodi di cottura che prevedono un’elevata temperatura sono la cottura alla griglia, l’arrostimento e la frittura. Al contrario, i metodi di cottura in umido o sotto forma di zuppa (nei quali la carne viene immersa in acqua), prevedono temperature comprese tra i 98° e 120°C; con questi metodi raramente si formano agenti cancerogeni (Tareke, Rydberg, Karlsson, Eriksson, & Tornqvist, 2002). La quantità di sostanze nocive prodotte durante la cottura può variare anche a seconda dell’utensile impiegato per la cottura, del grado di cottura della carne (cioè al sangue, mediamente al sangue, a cottura media e ben cotta), del contatto diretto o indiretto con la fonte di calore e dalla tipologia di fonte del calore. Oz e Yuzer (2016) hanno confrontato la produzione di HCA e PAH nelle bistecche di manzo grigliate su piastre di ferro o di pietra. Hanno evidenziato che la carne bovina grigliata su piastra di ferro produceva più HCA e meno PAH e che le HCA generate dipendevano anche dallo spessore della carne e dalla sua distanza dal fuoco. Gli autori hanno anche effettuato confronti basandosi sulla tipologia di fonte di calore ed hanno riferito che quando il carbone e i trucioli di legna venivano utilizzati insieme per il barbecue, la produzione di HCA tendeva ad essere maggiore. La carne di maiale e di manzo cotta sulla griglia ad elevate temperature e a diretto contatto con la fonte di calore ha portato alla formazione di quattro tipologie di PAH: benzo[a]antracene (B[a]A), crisene (Chr), benzop[b]fluorantene (B[b]F), e BaP, che potrebbero essere ridotti eliminando il fondo di cottura che rimane sulla pentola e la formazione di fumo prodotto durante la cottura. Eliminando il grasso della carne suina e bovina rilasciato durante la cottura, le 4 tipologie di PAH si sono ridotte dal 49% al 48%. Eliminando i fumi prodotti durante la cottura, si sono ridotti dal 74% al 41%. Questi risultati ci indicano come il fumo derivante dalla combustione incompleta del grasso della carne che cade sulla fonte di calore durante la cottura potrebbe essere un fattore molto influente nella produzione di PAH (Lee et al., 2016). Per quanto riguarda la cottura alla griglia della pancetta di maiale usando carbone, carbonella, ultravioletto, griglia elettrica e bistecchiera, la formazione di BaP è risultata maggiore impiegando il carbone di legna (Tabella 4). Il BaP si è formato quando la cottura prevedeva l’utilizzo di una fonte di calore diretta. La cottura su una fonte di calore indiretta non ha portato alla formazione di BaP, indipendentemente dal tempo di cottura impiegato o dall’aggiunta di altre sostanze (Park, Pyo, Kim, Kim, & Yoon, 2017). Pertanto, i rischi maggiori di produrre BaP sono dovuti, probabilmente, al contatto diretto tra la carne e la fonte di calore e al grasso della carne che sciogliendosi cade sulla fonte di calore stessa (Park et al., 2017).
Aggiunta di altre sostanze
La quantità di sostanze nocive prodotte durante la cottura potrebbe essere influenzata anche dall’aggiunta di varie altre sostanze.
Aggiunta di vitamine. Quando il contenuto di HCA è stato misurato in polpette di carne bovina cotte a 200°C per 3 minuti, alle quali erano state precedentemente aggiunte vitamine idrosolubili, si è visto che era diminuito. Esaminando le 12 tipologie di vitamine idrosolubili abbiamo evidenziato come l’aggiunta di piridossamina, piridossina, acido nicotinico, biotina, tiamina e acido L-ascorbico abbia ridotto la formazione di HCA e la piridossamina si è resa responsabile della diminuzione più marcata (Tabella 5) (Wong, Cheng, & Wang, 2012). Analogamente, un effetto inibitorio sulla mutagenesi è stato osservato in uno studio che misurava il tasso di inibizione della mutagenesi nella produzione di salsicce di maiale, in seguito all’aggiunta di acido L-ascorbico e α-tocoferolo (Pourazrang, Moazzami, & Fazly Bazzaz, 2002).
Aggiunta di spezie. La quantità di sostanze nocive prodotte durante la cottura può essere modificata a seconda delle spezie aggiunte. L’impiego del pepe in polvere, durante la frittura di polpette di carne ad elevato contenuto di grassi, ha ridotto il quantitativo totale di HCA (Tabella 6). Le polpette di carne cotte ad una temperatura di 175°senza l’aggiunta di pepe hanno prodotto 1.40 ng/g di HCA, quantitativo che si è ridotto a 0.93 ng/g dopo l’aggiunta di pepe in polvere. Quando la temperatura di cottura era di 200°C, le HCA totali sono diminuite da 5.70 a 5.03 ng/g, e a 225°C, le HCA totali sono passate da 37.81 ng/g ad un livello non rilevabile, indicando che l’aggiunta di pepe in polvere ha ridotto la produzione di HCA totali (Oz & Kaya, 2011). Oz e Kaya (2011) hanno evidenziato una diminuzione della formazione di HCA in seguito all’aggiunta di peperoncino e di pepe in polvere nella carne di manzo fritta in padella a 175, 200 e 225°C. La frittura in padella della carne bovina a 225°C ha generato 2.63 ng/g di HCA, scesi a 0.64 ng/g quando la carne è stata fritta in padella con l’aggiunta di peperoncino. Il numero di HCA totali si è ridotto da un 75% fino al 100% in seguito all’aggiunta di peperoncino durante la cottura (Oz & Kaya, 2011). Studi hanno riportato che l’impiego di spezie, tra cui curcuma, lemongrass, zenzero e foglie di curry durante l’arrostimento della carne bovina, è stato correlato ad una diminuzione del contenuto di HCA nocive. Per quanto riguarda le carni bovine arrostite a temperature medie (70°C), condire tali carne con 4 g/100 g di curcuma potrebbe ridurre l’IQ prodotto di ben 82 ng/100 g. Inoltre, condendo la carne con 10 g/100 g di lemongrass l’IQ si è ridotto di 44.4 ng/100 g, con 10 g/100 g di zenzero si è ridotto di 83 ng/100 g e condendo con 10 g/100 g di foglie di curry si è ridotto di 78.50 ng/100 g (Jinap, Iqbal, & Selvam, 2015).
Aggiunta di altri alimenti. Janoszka (2010) ha riportato che, durante l’arrostimento in padella della bistecca di collo, della braciola e della carne di maiale macinata, l’aggiunta di cipolla e di aglio ha ridotto la produzione di amino–azaareni (HCA) e di aza–areni (aza-PAH). L’aggiunta di 30 g di cipolla a 100 g di carne suina ha fatto si che la produzione di HCA diminuisse da un 31% ad un 49% e c’è stata anche una diminuzione degli aza-PAH, passata da un 21% ad un 48%. Analogamente, l’aggiunta di 15 g di aglio a 100 g di carne suina ha ridotto la produzione di HCA che è passata da 26% al 36% e di aza-PAH dal 33% al 40%. Per quanto concerne la pancetta di maiale arrostita, l’impiego di marinate a base di tè ha incrementato l’attività antiossidante ed ha prevenuto l’ossidazione lipidica, in base alla concentrazione di tè utilizzata e al tempo di marinatura (Park et al., 2017). Tra le marinate a base di tè, il tè yerba mate si è rivelato più efficace del tè verde nel prevenire la formazione di BaP durante la cottura. Una concentrazione ottimale della marinata a base di tè dello 0.5%, ed una marinatura della durata di almeno 8 ore, hanno avuto gli effetti maggiori sulla prevenzione della formazione dei BaP (Park et al., 2017). In linea con quanto detto, la marinata a base di tè verde ha ridotto significativamente i composti delle HCA PhIP e 2-amino-9H-pirido[2,3-b]indolo (AαC) durante l’arrostimento in padella della carne bovina a 180-200°C per 4 min. Più lungo era il tempo di marinatura, più significativa era la diminuzione della concentrazione di HCA quando la carne veniva arrostita (Quelhas et al., 2010). La produzione di PAH si è ridotta quando la carne bovina è stata arrostita dopo una marinatura rispetto a quando non ne veniva utilizzata alcuna. Tra le varie marinate, l’impiego di quella acida contenente l’1.2% di succo di limone ha ridotto significativamente la produzione di PAH del 70% circa (Farhadian, Jinap,Hanifah, & Zaidul, 2011).
Aggiunta di altre sostanze. Quando il chitosano a basso e a medio peso molecolare è stato cosparso sulla superficie della braciola di manzo prima della cottura a 150, 200 e 250°C, la produzione di HCA totali si è ridotta dal 14.3% al 100%, grazie all’aumento dell’umidità della carne mediato dal chitosano stesso (Oz & Cakmak, 2016). Quando alle polpette di carne bovina, prima della cottura alla griglia a 150, 200 o 250°C, è stato aggiunto l’acido linoleico coniugato (CLA), gli HCA totali sono andati incontro a variazioni. L’aggiunta dello 0.25% di CLA ed una cottura alla griglia con temperatura di 150 °C ha portato all’individuazione del più basso livello di HCA totali (Oz & Cakmak, 2016). L’aggiunta di un antiossidante, come quello contenuto nelle foglie di bambù, di estratto di liquirizia, del polifenolo del tè verde, dell’acido fitico e dell’ascorbato di sodio, si è rivelata una buona strategia utile a sopprimere la produzione di HCA (Tabella 6) (Janoszka, Blaszczyk, Damasiewicz-Bodzek, & Sajewicz, 2009; Zhang, Yu, Mei, & Wang, 2013).
Tabella 6-Prozuzione di HCA dalla carne, dai residui della padella e dal fondo di cottura della carne a seconda del metodo di cottura e della tipologia di carne.
Altre condizioni di cottura. Il riscaldamento della carne suina macinata e marinata in un tegame coperto a 98 °C ha portato al rilevamento di un livello maggiore di HCA nel fondo di cottura nella pentola piuttosto che sulla carne cotta stessa (Lan, Kao, & Chen, 2004). Ciò concorda con il report di Lan e Chen (2002), nel quale è stato evidenziato un livello più elevato di HCA nel fondo di cottura che non nella carne stessa. Inoltre, la quantità di sostanze nocive prodotte variava a seconda del riscaldamento cui veniva sottoposta la carne già cotta, del metodo di conservazione e delle varie condizioni di lavorazione messe in atto durante la realizzazione di prodotti trasformati a base di carne. Il riscaldamento della carne già cotta o lo stoccaggio a temperatura tiepida non ha influito sulla formazione di mutageni (Choe et al., 2018). L’arrostimento della carne a 200°C è stato associato ad una maggior formazione di composti mutageni durante i primi 6 minuti di cottura e il proseguimento della cottura per altri 25 minuti non ha portato alla formazione di nuovi composti. Il riscaldamento di hamburger di maiale arrostiti fino ad una temperatura al cuore di 70°C, o la conservazione della carne a 60°C per un massimo di 9, ore non ha influenzato in maniera significativa l’attività mutagena (Berg, Overvik, & Gustafsson, 1990). Durante la stagionatura a secco delle salsicce, l’involucro di collagene ha ridotto la produzione di PAH totali all’incirca di più di tre volte di quanto non abbia fatto il budello di maiale, indipendentemente dal contenuto di grasso o dal metodo di affumicatura. Sebbene il budello costituisca solo l’1-2% della massa totale di una salsiccia, è responsabile da un 5% ad un 21% della formazione dei PHA totali, suggerendoci che sul budello si forma un livello relativamente elevato di PHA. Ecco perché l’involucro delle salsicce dovrebbe essere rimosso prima di mangiarle (Gomes, Santos, Almeida, Elias, & Roseiro, 2013). La quantità di HCA che si formano durante la cottura alla griglia del controfiletto di bovino può aumentare con l’aumentare del tempo di frollatura (Polak, Dosler, Zlender, & Gasperlin, 2009).
Formazione di sostanze nocive in altri alimenti diversi dalla carne rossa
HCA eterociclici
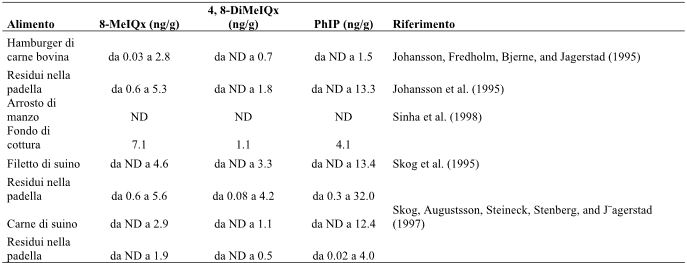
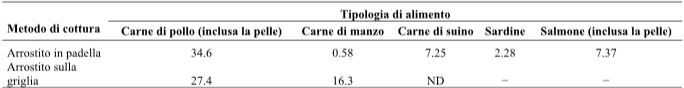
Iwasaki et al. (2010) hanno descritto il rapido aumento dei livelli di HCA, compresi PhIP, MeIQx e 4.8-DiMeIQx, durante la cottura della carne rossa e del pesce fino a che non risultano completamente cotti. La carne di pollo, di manzo, di maiale, le sardine e il salmone cotti in padella con l’aggiunta di olio, producono tutti PhIP, con una produzione maggiore nella carne di pollo (una tipologia di carne bianca) piuttosto che nella carne rossa, come quella di manzo e di maiale (Tabella 7). Sul pollo arrostito in padella e alla griglia abbiamo rilevato 34.6 e 27.4 ng/g di HCA (PhIP), mentre sul manzo cotto in maniera analoga abbiamo riscontrato, rispettivamente, 0.58 e 16.3 ng/g di PhIP. A paragone, il maiale arrostito in padella, le sardine e il salmone hanno mostrato concentrazioni di PhIP rispettivamente di 7.25, 2.28 e 7.37 ng/g, mentre il PhIP non è stato proprio rilevato in nessuno dei tre alimenti (Tabella 7). Puangsombat et al. (2012) hanno analizzato il contenuto di HCA prodotti dal pesce durante la frittura o la cottura alla griglia. La formazione di elevate quantità di HCA è stata osservata durante la frittura. Risultati simili sono stati evidenziati per la carne di maiale e il pesce. Quando l’assunzione di sostanze nocive originatesi da prodotti a base di carne cotti alla brace è stata calcolata basandosi sul consumo di 100 g di carne grigliata, la carne di manzo e il salmone contenevano quantità simili di HCA non di tipo IQ, mentre la carne di pollo ne conteneva il doppio (Viegas, Novo, Pinto, Pinho, & Ferreira, 2012). Livelli considerevolmente più elevati di HCA di tipo IQ sono stati osservati nel salmone e nella carne di pollo mentre la carne di manzo ne conteneva livelli più bassi. Dal salmone si è prodotta la quantità più elevata di PAH, con la carne bovina che ne produceva livelli nettamente inferiori (Viegas et al., 2012).
Tabella 7-Produzione di PhIP (ng/g) a seconda della tipologia di alimento e del metodo di cottura.
PAH
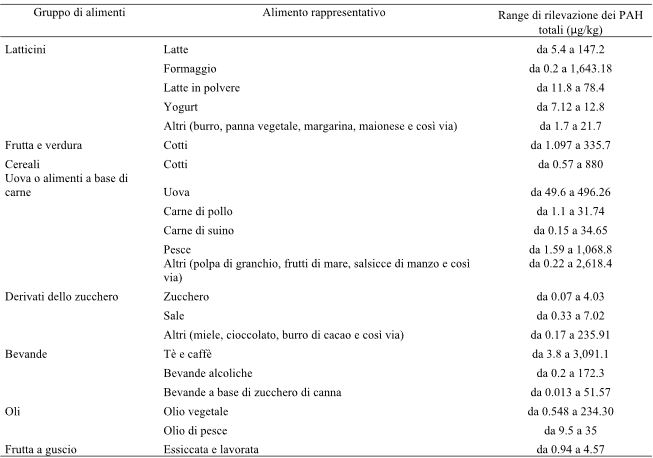
Singh et al. (2016) hanno descritto che i PAH (idrocarburi policiclici aromatici) sono presenti nella maggior parte degli alimenti, compresi i latticini, la frutta e la verdura, i cereali, il pesce, i frutti di mare, i derivati dello zucchero, le bevande, i grassi e gli oli e nella frutta a guscio (Tabella 8). Tra tutti questi, i quantitativi relativamente più elevati di PAH sono stati rilevati in una tipologia di caffè chiamato Dark Sumatra (3091.1 μg/kg) e, tra i frutti di mare, nella carne di granchio (2618.4 μg/kg) (tabella 8).
Tabella 8-Produzione di PAH dai diversi gruppi di alimenti
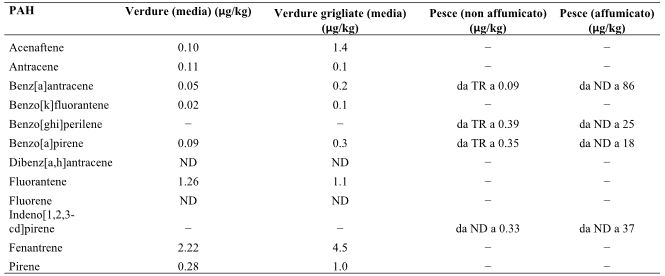
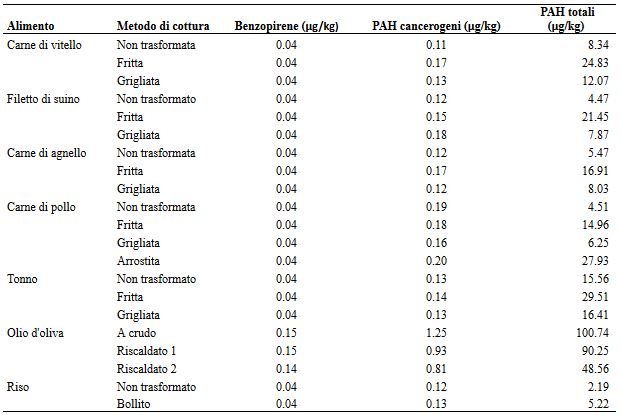
Visto che nella carne rossa la formazione dei PAH è influenzata dal tempo, dalla temperatura e dal metodo di cottura, anche la quantità di PAH prodotti dal caffè può variare in base alle condizioni di tostatura cui viene sottoposto, che includono il tempo, il livello di tostatura e gli strumenti utilizzati durante questo processo (Jimenez, Adisa, Woodham, & Saleh, 2014; Mostafa, 2002; Vieira et al., 2010). In uno studio condotto nel Regno Unito, gli alimenti che influenzavano maggiormente il contenuto di PAH nella dieta erano i cereali, i grassi e gli oli (piuttosto che le carni), e ciascuno di essi era responsabile di un terzo circa del livello totale di esposizione ai PAH per individuo. (Phillips, 1999). Anche frutta, verdura e zuccheri rappresentavano una bella percentuale, mentre la carne, il pesce, il latte e le bevande hanno avuto solo un’influenza marginale sulla produzione di PAH. Analogamente, in uno studio condotto in Germania, i cereali, i grassi e gli oli sono stati gli alimenti che hanno contribuito maggiormente alla presenza dei PAH (de Vos, van Dokkum, Schouten, & de Jong Berkhout, 1990; Phillips, 1999). Inoltre, quando sono state messe a confronto una dieta vegetariana (che promuoveva un elevato consumo di verdure a foglia e di cereali non raffinati) con una dieta usuale, si è visto che la dieta vegetariana incrementava l’assunzione di PAH (Menzie et al., 1992). Gli alimenti non appartenenti alla categoria della carne, producevano più PAH dopo la cottura piuttosto che prima della cottura. Confrontando le verdure fresche con quelle grigliate, si è evidenziata una maggiore produzione di PAH nelle verdure grigliate (Tamakawa, 2008; Tateno, Nagumo, & Suenaga, 1990). Analogamente, anche il pesce mostrava una maggiore produzione di PAH dopo l’affumicatura (McGill, Mackie, Parsons, Bruce, & Hardy, 1982; Tamakawa, 2008) (Tabella 9). Perello, Marti-Cid, Castell, Llobet e Domingo (2009) riferiscono che i PAH totali nelle carni suine non cotte sono inferiori a quelli della carne di vitello o di agnello, che sono anch’esse carni rosse (tabella 10). Inoltre, i PAH totali presenti nella carne suina (carne rossa) e nella carne di pollo (carne bianca) erano comparabili, mentre erano sensibilmente superiori rispetto a quelli presenti nel tonno o nell’olio d’oliva. Sebbene i PAH totali siano aumentati dopo la cottura della carne di suino (rispetto ai livelli contenuti in quella cruda), il livello di PAH cancerogeni non è cambiato significativamente dopo la cottura.
Tabella 9-Produzione di PAH durante la cottura dei vegetali e del pesce.
Tabella 10-Produzione di PAH dai vari alimenti a seconda del metodo di cottura.
NOC
Ogunmodede, Ojo e Jegede (2016) hanno confrontato il contenuto di NOC in vari alimenti prima e dopo la cottura. Il maiale e tutti gli altri alimenti hanno presentato una formazione maggiore di NOC nei campioni grigliati utilizzando il forno, la legna da ardere o il carbone di legna, rispetto al periodo antecedente la cottura (Tabella 11). Park et al. (2015) hanno misurato il contenuto di N-nitrosamina in vari campioni di alimenti, inclusa la carne della dieta e i prodotti a base di carne trasformata. Tra le N-nitrosammine, la NDMA e la NDEA vengono classificate dall’IARC come probabili agenti cancerogeni del Gruppo 2A. Si è così stabilito che il loro contenuto sarebbe stato significativo in relazione alle sostanze nocive, che sono diventate il focus del confronto. Il contenuto di NDMA e NDEA nella carne della dieta e nei prodotti a base di carne trasformati può sembrare, in un primo momento, più elevato rispetto a quello di altri cibi; tuttavia, tale contenuto era di gran lunga inferiore rispetto a quello presente nei frutti di mare. Inoltre, nel caso della NDMA, nella carne se ne sono formate quantità nettamente inferiori rispetto a quelle riscontrate nelle salse e nei prodotti derivati dall’olio vegetale (tabella 12). Riassumendo i risultati dell’indagine, la correlazione tra carne rossa e cancro del colon-retto potrebbe avere due spiegazioni scientifiche. La prima è che il sovraccarico di ferro, legato al consumo di carne rossa, può indurre stress ossidativo e portare alla carcinogenesi. La seconda è che la produzione di sostanze nocive, tra cui HCA, PAH e NOC, durante la cottura e la lavorazione della carne rossa potrebbe provocare il cancro. Oltre ai fattori estrinseci, come la lavorazione e la cottura, l’unico fattore intrinseco appartenente alla carne rossa che può contribuire alla carcinogenesi è il contenuto di ferro. Anche altri alimenti diversi dalla carne rossa (da 0 a 6.4 mg/100 g), come frutta (da 0 a 3.7 mg/100 g), verdura (da 0.2 a 11 mg/100 g), pesce (da 0.3 a 18.3 mg/100 g), tè (da 2.4 a 22.6 mg/100 g) e spezie (da 8.2 a 30.7 mg/100 g), presentano un elevato contenuto di ferro (HealthLinkBC, 2017). Pertanto, affermare che la carne rossa sia cancerogena a causa del suo contenuto di ferro manca di una base logica. Inoltre, è stato dimostrato che il contenuto di ferro nella carne suina, una carne rossa rappresentativa, è inferiore a quello della carne di manzo o di agnello. Se è vero che durante la cottura e la lavorazione della carne rossa si producono varie sostanze nocive, il loro contenuto è dell’ordine di nanogrammi e quindi inferiore di un milionesimo rispetto alle quantità ritenute rilevanti come potenzialmente cancerogene. Inoltre, un livello simile di sostanze nocive è stato riscontrato anche in alimenti diversi dalla carne rossa, ad esempio nei prodotti agricoli, nei prodotti ittici, nell’olio vegetale, nei prodotti lattiero-caseari, nelle bevande alcoliche e nella pasta di fagioli di soia. Pertanto, non è plausibile limitare la spiegazione del comportamento cancerogeno sulla base di tali sostanze nocive solo alle carni rosse. Inoltre, il fatto che la produzione di tali sostanze nocive possa variare a seconda del metodo di lavorazione e di cottura dovrebbe essere tenuto in considerazione per tutti gli alimenti, oltre che per la carne rossa. Da notare che quando sono stati presi in esame i dati statistici relativi alla popolazione coreana, sul consumo di carne rossa, pesce, frutta e verdura e sul tasso di alcolismo, sul consumo di tabacco, sul sovrappeso e sull’obesità, così come sull’aspettativa di vita, è risultato molto più impegnativo spiegare la patogenesi del cancro colorettale basandoci su di un singolo specifico fattore.
Tabella 11-Produzione di N-nitroso composti nei vari alimenti cotti e crudi e a seconda del metodo di cottura.
Tabella 12-Produzione di N-nitroso composti dai vari alimenti.
Conclusioni
La nostra review delle ricerche più recenti indica che la carne rossa non può essere ritenuta l’unica causa principale responsabile dell’aumento dell’incidenza del cancro del colon-retto. L’incidenza del cancro, compreso quello colorettale, è complessa ed è influenzata da vari altri fattori, tra cui l’età, i fattori genetici, le abitudini alimentari, l’ambiente e lo stile di vita condotto dagli individui. Tutto ciò suggerisce la necessità di effettuare uno studio di coorte che abbia come target differenti etnie e regioni geografiche, con ambienti naturali e una cultura del consumo di alimenti diverse. In Corea, inoltre, nonostante un minor consumo di carne rossa o di prodotti a base di carne lavorata, il fatto che l’incidenza del cancro colorettale sia superiore a quella dei paesi occidentali sembrerebbe non trovare riscontro. Il cancro del colon-retto è la terza tipologia di cancro più comune al mondo ed una delle principali cause di morte dovuta a neoplasia. Questo potrebbe essere dovuto all’influenza di altri fattori, come il consumo eccessivo di alcol, di sigarette, l’elevato livello di stress o il consumo di sale. Pertanto l’affermare che il consumo di carne rossa da parte degli asiatici, compresi i coreani, sia la causa principale della patogenesi del cancro del colon-retto manca di una certa logicità. Dovrebbero essere condotti studi epidemiologici per identificare l’esistenza di una correlazione tra i vari fattori e l’incidenza del cancro colorettale in una certa regione geografica o in uno specifico paese. Inoltre, si sa molto poco sui fattori genetici che potrebbero contribuire ad incrementare la suscettibilità al cancro del colon-retto nella popolazione coreana che consuma carne rossa. Detto ciò è evidente come sia necessaria altra ricerca futura per determinare il rapporto tra le caratteristiche genetiche e il rischio di cancro del colon-retto. Inoltre, sono essenziali dati più oggettivi e precisi sulla sicurezza della carne rossa presente nella dieta.
Conflitto di interessi
Gli autori dichiarano l’assenza di qualsiasi potenziale conflitto di interessi.
Contributi degli autori
Ideazione: Lee, Jo, Yoon, Jeong e Hur; Validazione: Lee; Stesura: Hur e Yoon; Review e pubblicazione: Jo, Jeong, e Lee.
Riferimenti
Alisson-Silva, F., Kawanishi, K., & Varki, A. (2016). Human risk of diseases associated with red meat intake: Analysis of current theories and proposed role for metabolic incorporation of a non-human sialic acid. Molecular Aspects of Medicine, 51, 16–30.
ANSES. (2015). Retrieved from https://www.anses.fr/fr/content/viandesrouges-viandes-transform%C3%A9es-et-cancers-point-sur-la-nouvelleclassification-du-circ
Aygun, S. F., & Kabadayi, F. (2005). Determination of benzo[a]pyrene in charcoal grilled meat samples by HPLC with fluorescence detection. International Journal of Food Science and Nutrition, 56(8), 581–585.
Bastide, N. M., Pierre, F. H. F., & Corpet, D. E. (2011). Heme iron from meat and risk of colorectal cancer: A meta-analysis and a review of the mechanisms involved. Cancer Prevention Research, 4, 177–184. https://doi.org/10.1158/1940-6207.CAPR-10-0113
Bellavia, A., Stilling, F., & Wolk, A. (2016). High red meat intake and all-cause cardiovascular and cancer mortality: Is the risk modified by fruit and vegetable intake?. American Journal of Clinical Nutrition, 104, 1137–1143.
Berg, I., Overvik, E., & Gustafsson, J. A. (1990). Effect of cooking time on mutagen formation in smoke, crust and pan residue from pan-broiled pork. Food Chemical Toxicology, 28, 421–426.
Boada, L. D., Hernandez, L. A. H., & Luzardo, O. P. (2016). The impact of red and processed meat consumption on cancer and other health outcomes: Epidemiological evidences. Food and Chemical Toxicology, 92, 236–244. https://doi.org/10.1016/j.fct.2016.04.008
Bogen, K. T. (1994). Cancer potencies of heterocyclic amines found in cooked foods. Food and Chemical Toxicology, 32(6), 505–515.
Chan, D. S., Lau, R., Aune, D., Vieira, R., Greenwood, D. C., Kampman, E., & Norat, T. (2011). Red and processed meat and colorectal cancer incidence: Meta-analysis of prospective studies. PLoS ONE, 6, e20456. https://doi.org/10.1371/journal.pone.0020456
Chiavarini, M., Bertarelli, G., Minelli, L., & Fabiani, R. (2017). Dietary intake of meat cooking-related mutagens (HCAs) and risk of colorectal adenoma and cancer: A systematic review and meta-analysis. Nutrients, 9514, 1–22.
Choe, J., Min, J. S., Lee, S. O., Khan, M. I., Yim, D. G., Lee, M., & Jo, C. (2018). Influence of cooking, storage period, and re-heating on production of cholesterol oxides in chicken meat. Korean Journal for Food Science of Animal Resources, 38, 433–441. https://doi.org/10.5851/kosfa.2018.38.3.433
Cross, A. J., & Sinha, R. (2004). Meat-related mutagens/carcinogens in the etiology of colorectal cancer. Environmental and Molecular Mutagenesis, 44, 44–55.
Czerwonka, M., & Tokarz, A. (2017). Iron in red meat—Friend or foe. Meat Science, 123, 157–165.
Da Silva, F. C., Wernhoff, P., Dominguez-Barrera, C., & Dominguez-Valentin, M. (2016). Update on hereditary colorectal cancer. Anticancer Research, 36(9), 4399–4405.
de Vos, R. H., van Dokkum, W., Schouten, A., & de Jong-Berkhout, P. (1990). Polycyclic aromatic hydrocarbons in Dutch total diet samples (1984-1986). Food and Chemical Toxicology, 28, 263–268.
Demeyer, D., Mertens, B., De Smet, S., & Ulens, M. (2016). Mechanisms linking colorectal cancer to the consumption of (processed) red meat: A review. Critical Reviews in Food Science and Nutrition, 56(16), 2747–2766.
EFSA (European Food Safety Authority). (2015). Scientific opinion on dietary reference values for iron. EFSA Journal, 13, 4254.
Ekmekcioglu, C., Wallner, P., Kundi, M., Weisz, U., Haas, W., & Hutter, H. P. (2018). Red meat, diseases, and healthy alternatives: A critical review. Critical Reviews in Food Science and Nutrition, 58(2), 247–261.
European Commission Scientific Committee on Foods. (2002). Opinion of the Scientific Committee on Food on the risks to human health of polycyclic aromatic hydrocarbons in food. Expressed on 4 December 2002. Health and Consumer Protection Directorate-General, European Commission, Brussels (document SCF/CS/CNTM/PAH/29 Final; Retrieved from http://europa.eu.int/comm/food/fs/sc/scf/outcome_en.html).
FAO. (2016). FAOStat. Food Balance Sheets Database. Food and Agriculture Organization of the United Nations (FAO). Retrieved from http://www.fao.org/faostat/en/#data/FBS.
Farhadian, A., Jinap, S., Hanifah, H. N., & Zaidul, I. S. (2011). Effects of meat preheating and wrapping on the levels of polycyclic aromatic hydrocarbons in charcoal-grilled meat. Food Chemistry, 124, 141–146.
Ferlay, J., Soerjomataram, I., Ervik, M., Dikshit, R., Eser, S., Mathers, C., & Bray, F. (2013). GLOBOCAN 2012 v1.0, Cancer Incidence and Mortality Worldwide: IARC CancerBase No. 11 [Internet]. Lyon, France: International Agency for Research on Cancer. Retrieved from http://globocan.iarc.fr
Food Safety Authority of Ireland (FSAI). (2015). Retrieved from https://www.fsai.ie
Food Safety Commission of Japan (FSCJ). (2015). Retrieved from https://www.fsc.go.jp/fscj_message_20151130.html
Gibis, M. (2016). Heterocyclic aromatic amines in cooked meat products: Causes, formation, occurrence, and risk assessment. Comprehensive Reviews in Food Science and Food Safety, 15, 269–302. https://doi.org/10.1111/1541-4337.12186
Gilsing, A. M., Berndt, S. I., Ruder, E. H., Graubard, B. I., Ferrucci, L. M., Burdett, L., & Sinha, R. (2012). Meat-related mutagen exposure, xenobiotic metabolizing gene polymorphisms and the risk of advanced colorectal adenoma and cancer. Carcinoigenesis, 33, 1332–1339.
Gomes, A., Santos, C., Almeida, J., Elias, M., & Roseiro, L. C. (2013). Effect of fat content, casing type and smoking procedures on PAHs contents of Portuguese traditional dry fermented sausages. Food and Chemical Toxicology, 58, 369–374.
HealthLinkBC. (2017). Iron in foods. Nutrition Series, HealthLinkBC File number: 68d. Retrieved from https://www.healthlinkbc.ca/healthlinkbc-files/iron-foods
Huang, X. (2003). Iron overload and its association with cancer risk in humans: Evidence for iron as a carcinogenic metal. Mutation Research, 533, 153–171.
Hunt, J. R. (2003). Bioavailability of iron, zinc, and other trace minerals from vegetarian diets. American Journal of Clinical Nutrition, 78, 633S–639S. https://doi.org/10.1093/ajcn/78.3.633S
Hur, S. J., Jo, C., Yoon, Y., Jeong, J. Y., & Lee, K. T. (2019). Controversy on the correlation of red and processed meat consumption with colorectal cancer risk: An Asian perspective. Critical Reviews in Food Science and Nutrition, 10, 1–12. https://doi.org/10.1080/10408398.2018.1495615
Iwasaki, M., Kataoka, H., Ishihara, J., Takachi, R., Hamada, G. S., Sharma, S., & Tsugane, S. (2010). Heterocyclic amines content of meat and fish cooked by Brazilian methods. Journal of Food Composition and Analysis, 23, 61–69.
Janoszka, B. (2010). Heterocyclic amines and azaarenes in pan-fried meat and its gravy fried without additives and in the presence of onion and garlic. Food Chemistry, 120, 463–473.
Janoszka, B., Blaszczyk, U., Damasiewicz-Bodzek, A., & Sajewicz, M. (2009). Analysis of heterocyclic amines (Has) in pan-fried pork meat and its gravy by liquid chromatography with diode array detection. Food Chemistry, 113, 1188–1196.
Jiang, R., Ma, J., Ascherio, A., Stampfer M, J., Willett, W. C., & Hu, F. B. (2004). Dietary iron intake and blood donations in relation to risk of type 2 diabetes in men: A prospective cohort study. American Journal of Clinical Nutrition, 79, 70–75. https://doi.org/10.1093/ajcn/79.1.70
Jimenez, A., Adisa, A., Woodham, C., & Saleh, M. (2014). Determination of polycyclic aromatic hydrocarbons in roasted coffee. Journal of Environmental Science and Health, Part B, Pesticides, Food Contaminants, and Agricultural Wastes, 49, 828–835.
Jinap, S., Iqbal, S. Z., & Selvam, R. M. P. (2015). Effect of selected local spices marinades on the reduction of heterocyclic amines in grilled beef (satay). LWT – Food Science and Technology, 63, 919–926.
Johansson, M. A. E., Fredholm, L., Bjerne, I., & Jagerstad, M. (1995). Influence of frying fat on the formation of heterocyclic amines in fried beef burgers and pan residues. Food and Chemical Toxicology, 33, 993–1004.
Jun, S., Ha, K., Chung, S., & Joung, H. (2016). Meat and milk intake in the rice-based Korean diet: Impact on cancer and metabolic syndrome. Proceedings of the Nutrition Society, 75(3), 374–384.
Klurfeld, D. M. (2016). How certain can we be about the association of meat consumption and cancer? Journal of Animal Science Suppl 5, 94, 437.
Korea Centers for Disease Control & Prevention. (2016). Korea National Health and Nutrition Examination Survey. Retrieved from http://knhanes.cdc.go.kr/knhanes
Lan, C. M., & Chen, B. H. (2002). Effects of soy sauce and sugar on the formation of heterocyclic amines in marinated foods. Food and Chemical Toxicology, 40, 989–1000.
Lan, C. M., Kao, T. H., & Chen, B. H. (2004). Effects of heating time and antioxidants on the formation of heterocyclic amines in marinated foods. Journal of Chromatography B, 802, 27–37.
Le, N. T., Michels, F. A., Song, M., Zhang, X., Bernstein, A. M.,& Wu, K. (2016). A prospective analysis of meat mutagens and colorectal cancer in the Nurses’ Health Study and Health Professionals Follow-up Study. Environmental Health Perspective, 124, 1529–1536. https://doi.org/10.1289/EHP238
Lee, J. G., Kim, S. Y., Moon, J. S., Kim, S. H., Kang, D. H., & Yoon, H. J. (2016). Effects of grilling procedures on levels of polycyclic aromatic hydrocarbons in grilled meats. Food Chemistry, 199, 632–638. https://doi.org/10.1016/j.foodchem.2015.12.017
Lee, K. T., Yoon, Y., Jeong, S. H., Jeong, J. Y., Jo, C., & Hur, S. J. (2017). Study on the consumption of risk assessment of red meat and investigation of scientific evidences (pp. 26–68). Korea Pork Board, Seoul, Korea.
Liao, G., Xu, X., & Zhou, G. (2009). Effects of cooked temperatures and addition of antioxidants on formation of heterocyclic aromatic amines in pork floss. Journal of Food Processing and Preservation, 33, 159–175.
McGill, A. S., Mackie, P. R., Parsons, E., Bruce, C., & Hardy, R. (1982). The polynuclear aromatic hydrocarbon content of smoked foods in the United Kingdom. In M. Cooke, A. J. Dennis, & G. L. Fisher (Eds.), Polynuclear aromatic hydrocarbons: Physical and biological chemistry (pp. 491–499). Columbus, OH: Battelle Press.
Menzie, C. A., Potocki, B. B., & Santodonato, J. (1992). Exposure to carcinogenic PAHs in the environment. Environmental Science & Technology, 26, 1278–1284.
Meurillon, M., & Engel, E. (2016). Mitigation strategies to reduce the impact of heterocyclic aromatic amines in proteinaceous foods. Trends in Food Science & Technology, 50, 70–84. https://doi.org/10.1016/j.tifs.2016.01.007
Mirvish, S. S. (1986). Effects of vitamins C and E on N-nitroso compound formation, carcinogenesis, and cancer. Cancer, 58, 1842–1850.
Mostafa, G. A. (2002). Monitoring of polycyclic aromatic hydrocarbons in seafoods from Lake Timsah. International Journal of Environmental Health Research, 12, 83–91.
OECD. (2015). Health at a glance 2015: OECD indicators. Paris: OECD Publishing. Retrieved from https://doi.org/10.1787/health_glance-2015-en
OECD Health Statistics. (2016). Non-medical determinants of health. Retrieved from http://stats.oecd.org/index.aspx?DataSetCode=HEALTH_STAT
Ogunmodede, O. T., Ojo, A. A., & Jegede, O. (2016). Comparative study of nitrosamine in roasted food base on the roasting methods. International Letters of Natural Sciences, 50, 23–26. https://doi.org/10.18052/www.scipress.com/ILNS.50.23
Oz, F., & Cakmak, I. H. (2016). The effects of conjugated linoleic acid usage in meatball production on the formation of heterocyclic aromatic amines. LWT – Food Science and Technology, 65, 1031–1037.
Oz, F., & Kaya, M. (2011). The inhibitory effect of red pepper on heterocyclic aromatic amines in fried beef longissimus dorsi muscle. Journal of Food Processing and Preservation, 35, 806–812.
Oz, F., & Yuzer, M. O. (2016). The effects of cooking on wire and stone barbecue at different cooking levels on the formation of heterocyclic aromatic amines and polycyclic aromatic hydrocarbons in beef steak. Food Chemistry, 203, 59–66.
Oz, F., & Zikirow, E. (2015). The effects of sous-vide cooking method on the formation of heterocyclic aromatic amines in beef chops. LWT – Food Science and Technology, 64, 120–125.
Park, J. E., Seo, J. E., Lee, J. Y., & Kwon, H. J. (2015). Distribution of seven N-nitrosamines in food. Toxicology Research, 31(3), 279–288. https://doi.org/10.5487/TR.2015.31.3.279
Park, K. C., Pyo, H. S., Kim, W. S., & Yoon, K. S. (2017). Effects of cooking methods and tea marinades on the formation of benzo[a]pyrene in grilled pork belly (Samgyeopsal). Meat Science, 129, 1–8. https://doi.org/10.1016/j.meatsci.2017.02.012
Perello, G., Marti-Cid, R., Castell, V., Llobet, J. M., & Domingo, J. L. (2009). Concentrations of polybrominated diphenyl ethers, hexachlorobenzene and polycyclic aromatic hydrocarbons in various foodstuffs before and after cooking. Food and Chemical Toxicology, 47, 709–715.
Phillips, D. H. (1999). Polycyclic aromatic hydrocarbons in the diet. Mutation Research/Genetic Toxicology and Environmental Mutagenesis, 443, 139–147.
Polak, T., Dosler, D., Zlender, B., & Gasperlin, L. (2009). Heterocyclic amines in aged and thermally treated pork longissimus dorsi muscle of normal and PSE quality. LWT – Food Science and Technology, 42, 504–513.
Pourazrang, H., Moazzami, A. A., & Fazly Bazzaz, B. S. (2002). Inhibition of mutagenic N-nitroso compound formation in sausage samples by using L-ascorbic acid and α-tocopherol. Meat Science, 62(4), 479–483.
Puangsombat, K., Gadgil, P., Houser, T. A., Hunt, M. C., & Smith, J. S. (2012). Occurrence of heterocyclic amines in cooked meat products. Meat Science, 90, 739–746. https://doi.org/10.1016/j.meatsci.2011.11.005
Quelhas, I., Petisca, C., Viegas, O., Melo, A., Pinho, O., & Ferreira, I. M. P. L. V. O.(2010). Effect of green tea marinades on the formation of heterocyclic aromatic amines and sensory quality of pan-fried beef. Food Chemistry, 122, 98–104.
RDA-NIAS (Rural Development Administration – National Institute of Agricultural Sciences). (2011). Korean Standard Food Composition Table, The 8th revision. Retrieved from http://koreanfood.rda.go.kr/kfi/fct/fctFoodSrch/list
Robbiano, L, Mereto, E, Corbu, C, & Brambilla, G. (1996). DNA damage induced by seven N-nitro compounds in primary cultures of human and rat kidney cells. Mutation Research/Genetic Toxicology, 368, 41–47.
Ross, J. A., & Kasum, C. M. (2002). Dietary flavonoids: Bioavailability, metabolic effects, and safety. Annual Review of Nutrition, 22, 19–34. https://doi.org/10.1146/annurev.nutr.22.111401.144957
Santarelli, R. L., Pierre, F., & Corpet, D. E. (2008). Processed meat and colorectal cancer: A review of epidemiologic and experimental evidence. Nutrition and Cancer, 60, 131–144. https://doi.org/10.1080/01635580701684872
Shin, A., Jung, K. W., Woo, H., & Jeong, S. Y. (2016). Colorectal cancer incidence in Korea is not the highest in the world. Cancer Research and Treatment, 48, 864–867. https://doi.org/10.4143/crt.2015.484
Shin, H. S. (2005). Influence of food ingredients on the formation of heterocyclic aromatic amine in cooked pork patties. Food Science and Biotechnology, 14, 572–575.
Singh, L., Varshney, J. G., & Agarwal, T. (2016). Polycyclic aromatic hydrocarbons’ formation and occurrence in processed food. Food Chemistry, 199, 768–781. https://doi.org/10.1016/j.foodchem.2015.12.074
Sinha, R., Rothman, N., Salmon, C. P., Knize, M. G., Brown, E. D., Swanson, C. A., & Levander, O. A. (1998). Heterocyclic amine content in beef cooked by different methods to varying degrees of doneness and gravy made from eat drippings. Food and Chemical Toxicology, 36, 279–287.
Skog, K., Augustsson, K., Steineck, G., Stenberg, M., & J¨agerstad, M. (1997). Polar and non-polar heterocyclic amines in cooked fish and meat products and their corresponding pan residues. Food and Chemical Toxicology, 35, 555–565.
Skog, K., Steineck, G., Augustsson, K., & J¨agerstad, M. (1995). Effect of cooking temperature on the formation of heterocyclic amines in fried meat products and pan residues. Carcinogenesis, 16(4), 861–867.
Sobiecki, J. G., Appleby, P. N., Bradbury, K. E., & Key, T. J. (2016). High compliance with dietary recommendations in a cohort of meat eaters, fish eaters, vegetarians, and vegans: Results from the European prospective investigation into cancer and nutrition-oxford study. Nutrition Research, 36, 464–477.
Surya, R., Helies-Toussaint, C., Martin, O. C., Gauthier, T., Gueraud, F., Tache, S., & Huc, L. (2016). Red meat and colorectal cancer: Nrf2-dependent antioxidant response contributes to the resistance of preneoplastic colon cells to fecal water of hemoglobin-and beef-fed rats. Carcinogenesis, 37, 635–645.
Tamakawa, K. (2008). Chepter 17 polycyclic aromatic hydrocarbons. Comprehensive Analytical Chemistry, 51, 599–651.
Tapiero, H., Gat´e, L., & Tew, K. D. (2001). Iron: Deficiencies and requirements. Biomedicine & Pharmacotherapy, 55, 324–332.
Tareke, E., Rydberg, P., Karlsson, P., Eriksson, S., & Tornqvist, M. (2002). Analysis of acrylamide, a carcinogen formed in heated foodstuffs. Journal of Agricultural Food and Chemistry, 50(17), 4998–5006.
Tateno, T., Nagumo, Y., & Suenaga, S. (1990). Polycyclic aromatic hydrocarbons produced from grilled vegetables. Food Hygiene and Safety Science, 31, 271–276.
Torti, S. V., & Torti, F. M. (2013). Iron and cancer: More ore to be mined. Nature Reviews, 13, 342–355. https://doi.org/10.1038/nrc3495
Toyokuni, S. (1996). Iron-induced carcinogenesis: The role of redox regulation. Free Radical Biology & Medicine, 20, 553–566.
Turney, N. D., & Lloyd, S. K. (2017). Association between red meat consumption and colon cancer: A systematic review of experimental results. Experimental Biology and Medicine, 242(8), 813–839.
USDA, U.S.Department of Agriculture. (2015). National nutrient database for standard reference. Retrieved from http://ndb.nal.usda.gov/ndb/foods/
Viegas, O., Novo, P., Pinto, E., Pinho, O. & Ferreira, I. M. P. L. V. O. (2012). Effect of charcoal types and grilling conditions on formation of heterocyclic aromatic amines (HAs) and polycyclic aromatic hydrocarbons (PAHs) in grilled muscle foods. Food and Chemical Toxicology, 50, 2128–2134.
Vieira, M. A., Maraschin, M., Rovaris, A. A., Amboni, R. D. M.C., Pagliosa, C. M., Xavier, J. J. M., & Amante, E. G. (2010). Occurrence of polycyclic aromatic hydrocarbons throughout the processing stages of erva-mate (Ilex paraguariensis). Food Additives & Contaminants: Part A, 27, 776–782.
Vineis, P., & Stewart, B. W. (2016). How do we judge what causes cancer? The meat controversy. International Journal of Cancer, 138, 2309–2311. https://doi.org/10.1002/ijc.30009
Wang, J., Joshi, A. D., Corral, R., Siegmund, K. D., Marchand, L. L., Martinez, M. E., & Stern, M. C. (2012). Carcinogen metabolism genes, red meat and poultry intake, and colorectal cancer risk. International Journal of Cancer, 130, 1898–1907.
Wong, D., Cheng, K. W., & Wang, M. (2012). Inhibition of heterocyclic amine formation by water-soluble vitamins in Maillard reaction model systems and beef patties. Food Chemistry, 133(3), 760–766.
Yang, S. Y., Kim, Y. S., Lee, J. E., Seol, J., Song, J. H., Chung, G. E., & Kim, J. S. (2016). Dietary protein and fat intake in relation to risk of colorectal adenoma in Korean. Medicine, 95(49), 1–9.
Zhang, Y., Yu, C., Mei, J., & Wang, S. (2013). Formation and mitigation of heterocyclic aromatic amines in fried pork. Food Additives & Contaminants: Part A, 30, 1501–1507.
Zheng, W., & Lee, S. A. (2009). Well-done meat intake, heterocyclic amine exposure, and cancer risk. Nutrition and Cancer, 61, 437–446.