Uno studio condotto presso l’Università di Berna (Svizzera), e basato su un lavoro di review presentato nel corso dell’ottava Conferenza della European Society of Veterinary and Comparative Nutrition, ha valutato gli effetti sui vitelli neonati delle sostanze nutritive e, soprattutto, di quelle non nutritive contenute nel colostro.
Il tratto gastroenterico (GIT) dei vitelli neonati è relativamente maturo, ma necessita ancora di cambiamenti morfologici e funzionali. L’assunzione di colostro, con le sue sostanze nutritive e non, esercita notevoli effetti sullo sviluppo e sulla funzionalità del sistema gastroenterico. L’assunzione di colostro garantisce protezione immunitaria (immunità passiva grazie alle immunoglobuline) ed è essenziale per la sopravvivenza dei neonati della maggior parte delle specie. Inoltre, abbiamo importanti effetti sistemici (transitori e di lunga durata) sullo status nutrizionale, sul metabolismo e sui vari sistemi endocrini in seguito all’ingestione delle sostanze nutritive e non nutritive presenti nel colostro, le quali contribuiscono alla sopravvivenza del vitello durante lo stressante periodo che segue la nascita. Il colostro è quindi molto più di una semplice fonte di immunoglobuline.
Introduzione
Tuttavia, sono necessari marcati cambiamenti morfologici e funzionali affinché l’animale riesca ad adattarsi ai diversi fattori ambientali, tra cui l’alimentazione. Nel neonato si ha un passaggio immediato dalla nutrizione principalmente di tipo parenterale (durante il periodo fetale) all’alimentazione esclusivamente enterale. L’assunzione di colostro è essenziale per la sopravvivenza dei vitelli durante il periodo neonatale, fa sì che inizino transitori fenomeni metabolici ed endocrini sistemici con effetti anche più duraturi nel tempo, soprattutto per quanto riguarda la protezione immunitaria e lo stato nutrizionale.
Componenti del colostro
Il colostro contiene sostanze nutritive (compresi i grassi essenziali e gli aminoacidi), minerali, oligoelementi e precursori/vitamine (soprattutto β-carotene, vitamine A, D ed E, oltre alle vitamine del gruppo B), componenti non nutritivi [immunoglobuline (Ig) e sostanze non-nutritive] e cellule [cellule epiteliali (lattociti), eritrociti, leucociti].
Nel colostro bovino molte componenti non nutritive e direttamente bioattive derivano dal sangue, come nel caso dell’immunoglobulina G1, dell’ormone della crescita (GH), della prolattina (PRL), dell’insulina e del glucagone. Altre sostanze non nutritive vengono prodotte nella ghiandola mammaria, in particolare dai lattociti, come ad esempio alcune delle proteine leganti l’IGF. La maggior parte di peptidi e proteine, ad eccezione della caseina e del lattosio, è già disponibile per i neonati nel primo colostro. In esso sono contenute molte sostanze non nutritive, comprese le immunoglobuline (soprattutto IgG1), gli ormoni, i fattori di rilascio, i fattori di crescita, le citochine, le prostaglandine, gli enzimi, la lattoferrina (Lf), la transferrina, i prodotti di degradazione delle proteine del latte, i nucleotidi, le poliammine e gli oligosaccaridi. Nel colostro bovino le concentrazioni di fattori di crescita insulino-simili (IGF) sono elevate, ma il fattore di crescita epidermico viene appena rilevato, diversamente dal colostro umano e di ratto. Le concentrazioni di peptidi non nutritivi diminuiscono rapidamente dopo l’inizio della lattazione. Le concentrazioni di molte di queste sostanze sono maggiori nel colostro piuttosto che nel sangue (IgG1, IGF e insulina), mentre alcune sono presenti in concentrazioni inferiori nel colostro rispetto al sangue [GH, glucagone, tiroxina (T4), 3.5.3’-triiodotironina (T3)].
Le sostanze non nutritive sono distribuite tra la frazione caseina, la frazione siero (ormoni peptidici, fattori di rilascio ormonale, fattori di crescita, citochine e altri peptidi bioattivi, compresi i prodotti di degradazione delle proteine e gli oligosaccaridi) e la frazione grassa (ormoni steroidei). Durante la mungitura le concentrazioni maggiori di IGF-1, IGF-2, insulina, PRL e altri peptidi si ritrovano nella frazione di latte cisternale, con quantità gradualmente inferiori nelle frazioni successive, a cui fa seguito un aumento verso la fine della mungitura, un modello che non coincide con i cambiamenti nel contenuto di sostanza secca. Di conseguenza, la disponibilità di queste componenti per il vitello che succhia il latte dalla madre è molto variabile.
Importanza biologica complessiva dell’assunzione di colostro e di latte da parte del neonato
È risaputo che il colostro fornisce nutrienti essenziali ai neonati, ma è sempre più evidente come questo eserciti effetti anche attraverso le sostanze non nutritive presenti al suo interno.
Infatti, i vitelli appena nati hanno bisogno di assorbire le Ig colostrali; Escherichia coli ed altre infezioni possono essere responsabili di elevati tassi di mortalità se le concentrazioni di IgG1 sono basse. L’assunzione di colostro provoca drastici cambiamenti morfologici e funzionali a livello del GIT nei neonati, come mostrato per la prima volta da Widdowson. Klagsbrun ha dimostrato per la prima volta che il latte contiene mitogeni che raggiungono concentrazioni più elevate nel colostro e che sono di natura diversa nel colostro bovino e umano. Vari ricercatori hanno poi scoperto che il colostro, rispetto al latte maturo, contiene maggiormente sostanze non nutrienti, e che tali sostanze modulano la popolazione microbica del GIT, hanno effetti profondi sul GIT (proliferazione, migrazione, differenziazione, apoptosi delle cellule epiteliali; sintesi e degradazione proteica; digestione, assorbimento, motilità; sviluppo e funzione del sistema immunitario) e, in parte, possono esercitare effetti sistemici al di fuori del tratto gastroenterico sul metabolismo e sui sistemi endocrini, sul tono vascolare e l’emostasi, sull’attività e sul comportamento e sulla crescita sistemica (Fig. 1).
Figura 1 – Effetti delle sostanze non nutritive sui tessuti materni e sui neonati.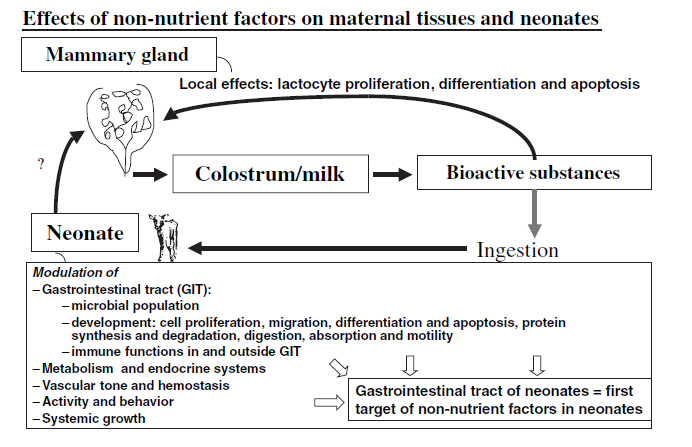
Effetti del colostro sul tratto gastrointestinale
I vitelli neonati sono pseudo-monogastrici, il cui GIT è caratterizzato da un marcato tasso di crescita. I cambiamenti nel GIT sono associati alla maturazione di altri organi coinvolti nella digestione (pancreas e fegato) (Guilloteau et al., 1997, 2002). L’assorbimento intestinale di grandi molecole proteiche e peptidi per mezzo della pinocitosi diminuisce dopo 7 giorni dalla nascita (p.n.), pertanto la digestione delle proteine nei lisosomi all’interno degli enterociti viene sostituita dalla digestione nel lume del tratto gastrointestinale e sulla superficie (orletto) degli enterociti (Blum, 2004). Una scadente funzionalità digerente, causata da una transizione insufficiente durante questo periodo, è seguita da disfunzioni aberranti del GIT e rappresenta una delle principali cause di morbilità e mortalità nei vitelli neonati.
Nei suini neonati le funzioni digestive e di assorbimento migliorano in caso di parto naturale (vaginale > taglio cesareo) (Sangild, 2001) e in seguito all’utilizzo di prodotti per le fasi iniziali dell’allattamento (colostro > sostituti del latte), di sostanze nutrienti e non nutrienti, dell’alimentazione enterale (> alimentazione parenterale) e dell’aumento della frequenza di allattamento.
Lo sviluppo del GIT è regolato dall’attivazione e dall’espressione genica (“orologio dello sviluppo”) e dipende dalla vascolarizzazione. L’alimento che raggiunge il GIT ha effetti sia diretti che indiretti. Gli effetti diretti del cibo ingerito dipendono dall’apporto di sostanze nutritive e non nutritive. Vi è un marcato aumento dello spessore della parete dell’intestino tenue (SI) entro poche ore dall’ingestione di colostro. Gli effetti sul GIT sono dovuti all’immagazzinamento delle proteine del latte assorbite (pinocitosi) (soprattutto IgG1), all’aumento delle sintesi proteiche e all’aumento della proliferazione cellulare.
La maturazione del GIT è modulata da molti fattori:
- nutrienti ingeriti;
- sostanze regolatrici prodotte (fattori di crescita, citochine e neurotrasmettitori), che agiscono all’interno della parete del GIT (effetti juxtacrini, autocrini e paracrini);
- sostanze regolatrici prodotte nel GIT e rilasciate nel lume intestinale (luminochine);
- sostanze regolatrici che vengono prodotte all’interno e all’esterno del GIT e che circolano nel sangue (Fig. 2).
Per quanto riguarda i peptidi regolatori del GIT, nei vitelli neonati è stata studiata la fisiologia di gastrina, colecistochinina, secretina, polipeptide vasointestinale, motilina, polipeptide pancreatico, somatostatina e polipeptide insulinotropico glucosio-dipendente. Il peptide glucagone-simile 2 esercita effetti trofici particolarmente marcati sul GIT.
Figura 2 – Effetti di ormoni, fattori di crescita e citochine sul GIT.
 Generalmente si ritiene che il cortisolo giochi un ruolo chiave nello sviluppo del GIT e nella differenziazione cellulare, in particolare nella promozione degli enzimi digestivi nel periodo pre e peri-natale. L’aumento del rilascio di cortisolo pre-, peri- e post-natale precoce o il trattamento con desametasone (se somministrato in quantità non troppo elevate) sembrerebbe accelerare la maturazione del GIT. Gli effetti dipendono dalla presenza, dal numero e dall’affinità di recettori specifici e dall’instaurarsi di eventi post-recettori. Esistono marcate differenze tra i siti nel GIT rispetto agli effetti dei regolatori. Questa regolazione è resa più complessa da importanti interazioni tra ormoni, fattori di crescita e citochine con il sistema nervoso autonomo. La differenziazione dell’epitelio è di primaria importanza per la funzionalità e la salute del GIT.
Generalmente si ritiene che il cortisolo giochi un ruolo chiave nello sviluppo del GIT e nella differenziazione cellulare, in particolare nella promozione degli enzimi digestivi nel periodo pre e peri-natale. L’aumento del rilascio di cortisolo pre-, peri- e post-natale precoce o il trattamento con desametasone (se somministrato in quantità non troppo elevate) sembrerebbe accelerare la maturazione del GIT. Gli effetti dipendono dalla presenza, dal numero e dall’affinità di recettori specifici e dall’instaurarsi di eventi post-recettori. Esistono marcate differenze tra i siti nel GIT rispetto agli effetti dei regolatori. Questa regolazione è resa più complessa da importanti interazioni tra ormoni, fattori di crescita e citochine con il sistema nervoso autonomo. La differenziazione dell’epitelio è di primaria importanza per la funzionalità e la salute del GIT.
Nei vitelli pre-ruminanti, l’epitelio del SI è, a questo riguardo, particolarmente importante perché è il sito primario di digestione, assorbimento e (o) esclusione dall’assorbimento di sostanze presenti nel lume del tratto intestinale. Il sistema epiteliale (in termini di profondità della cripta, di tasso di proliferazione delle cellule della cripta e di dimensione dei villi) del SI nei vitelli nati prematuri è molto meno reattivo all’alimentazione rispetto a quello dei vitelli nati a termine e risponde in modo diverso in termini di enzimi digestivi, sebbene le cellule epiteliali vacuolate spariscano dopo 1 settimana di alimentazione.
Nei vitelli nati a termine l’assunzione di colostro “normale” rispetto all’assunzione di sostituti del latte (o di “formule”) ha incrementato il tasso di proliferazione delle cellule delle cripte, ma non le dimensioni dei villi. L’ingestione massima versus quella “normale” di colostro o la somministrazione di un estratto di siero colostrale di prima mungitura (che contiene sostanze non nutritive, come IGF-1, insulina, ecc.) non hanno influenzato il tasso di proliferazione delle cellule della cripta, mentre le dimensioni dei villi sono aumentate, suggerendo che l’aumento delle dimensioni dei villi del SI è la conseguenza di una maggiore fissione delle cripte, di un aumento della velocità di migrazione delle cellule epiteliali delle cripte verso l’apice dei villi, di una riduzione del tasso di apoptosi o di un aumento del tasso di sopravvivenza. L’aumento dell’ingestione di colostro ha anche incrementato la capacità di assorbimento (per lo xilosio) in diversi studi. Pertanto, elevate quantità di colostro ingerito miglioravano la crescita dei villi e quindi il potenziale di assorbimento intestinale, anche se la profondità delle cripte non era correlata con la circonferenza e l’altezza dei villi.
Le correlazioni negative tra le dimensioni delle cellule della cripta e i tassi di proliferazione suggeriscono un controllo a feedback negativo della crescita delle cellule epiteliali del SI. Nei vitelli, durante i primi 5 giorni di vita, si osservano anche marcati cambiamenti ontogenetici nelle popolazioni di linfociti (aumento del tasso di proliferazione, diminuzione del tasso di apoptosi e del numero di linfociti T) nelle placche del Peyer (PP) e di linfociti T negli epiteli, ma non è stato osservato alcun cambiamento significativo del numero di linfociti B nella PP dell’ileo, probabilmente a causa degli effetti del colostro. L’alimentazione dei vitelli con colostro (contenente sostanze nutritive e non nutritive) rispetto alla somministrazione di sostituti (contenenti sostanze nutritive ma senza quasi alcuna sostanza non nutritiva) per 5 giorni ha fatto diminuire il numero di cellule in proliferazione nei follicoli e quello dei linfociti B nelle PP, ma non i tassi di apoptosi e il numero di linfociti T nell’ileo, suggerendoci che la somministrazione del colostro risparmiava le risposte dell’immunità attiva.
Sono stati condotti vari studi sugli effetti a livello del GIT di singoli ormoni o di fattori di crescita negli animali domestici o da laboratorio neonati. Nei suini e nei vitelli neonati, sono stati studiati principalmente gli effetti dell’IGF-1. Sulla base di questi studi, gli IGF possono sopravvivere in larga misura nel SI. Gli effetti di IGF-1 (e di IGF-2) sono mediati da specifici recettori che, nel GIT, sono presenti su cellule epiteliali, fibroblasti, endoteli e muscolatura liscia. I numeri dei recettori differiscono a seconda dei diversi siti nel GIT e cambiano in base all’età e all’alimentazione. La somministrazione parenterale di IGF-I migliora lo spessore della mucosa (epiteliale), della sottomucosa e della muscolare, la crescita longitudinale e trasversale del GIT, l’assorbimento di sodio e l’assorbimento di nutrienti sodio-dipendenti (glucosio). L’IGF-I umano ricombinante aggiunto alla formula artificiale ha aumentato la crescita dei villi intestinali, l’attività della lattasi e l’espressione dell’mRNA della lattasi nei suinetti allevati artificialmente. L’IGF-I somministrato per via orale ha inibito la degradazione proteolitica della lattasi e del suo precursore. L’assunzione di quantità fisiologiche di IGF-1 o di IGF-1 derivato dal latte aumenta la sintesi della lattasi e riduce l’attività dell’aminopeptidasi.
La somministrazione con la dieta di quantitativi farmacologici di IGF-1 aumenta in modo variabile il tasso di proliferazione delle cellule della cripta, riduce il tasso di apoptosi delle cellule epiteliali, aumenta le dimensioni dei villi e la sintesi proteica. Tuttavia, la crescita non è migliorata nei suini transgenici che sovraesprimono IGF-1. Non vi è un assorbimento significativo dell’IGF-1 ingerito . La regolazione degli effetti sul GIT degli IGF ingeriti, degli IGF prodotti all’interno del GIT stesso e degli IGF prodotti al di fuori del GIT e circolanti nel sangue è complessa. È ulteriormente complicata dalle interazioni con altri sistemi endocrini (GH, insulina e cortisolo), dalla modulazione (principalmente inibizione) degli effetti dell’IGF da parte delle IGFBP, dalla proteolisi delle IGFBP seguita dalla scissione dell’IGF e anche dalle possibili interazioni con Lf, come dimostrato nella ghiandola mammaria bovina. Abbiamo mostrato che l’mRNA per il recettore del GH (GHR), per i recettori dell’IGF di tipo 1 e 2 (IGF-1R, IGF-2R) e per il recettore dell’insulina (IR), di IGF-1 e IGF-2 e di IGFBP 1-3 sono presenti in tutte le parti del GIT dei vitelli neonati. Esistono differenze marcate per quanto riguarda i livelli di mRNA tra i diversi siti del GIT, e ciò suggerisce una sintesi di mRNA e (o) tassi di turnover variabili e un’importanza mutevole di questi tratti per la crescita e la maturazione del GIT stesso.
Nell’ileo di vitelli di 5 giorni, i livelli di mRNA differivano tra strati compartimentalizzati (frazioni) contenenti apici dei villi e cripte (nel digiuno) e apici dei villi, cripte e lamina propria (nell’ileo). Le componenti dell’asse somatotropo e dell’IR non sono quindi espresse in modo simile nei diversi strati del digiuno e dell’ileo dei vitelli neonati. Livelli maggiori di mRNA appartenenti al sistema GH-IGF-insulina (eccetto il recettore IGF-2) al giorno 5 rispetto al giorno 1 principalmente nel SI, suggeriscono che il SI potrebbe rappresentare un obiettivo principale per i fattori nutrizionali colostrali e/o per i fattori che promuovono la crescita. I livelli di mRNA e il numero massimo dei siti (Bmax; come indice del numero dei recettori) di IGF-1R, IGF-2R e IR erano negativamente correlati, e indicavano un turnover differenziale del recettore. La Bmax di IGF-1R, IGF-2R e IR è stata determinata anche nel SI e nel colon di vitelli neonati .
Questi studi hanno mostrato che la Bmax dell’IGF-2R è diminuita e quella delll’IR è aumentata, mentre la Bmax dell’IGF-1R non è cambiata durante la prima settimana di vita; La Bmax di IGF-1R, IGF-2R e IR è stata modificata dalle differenze di alimentazione e la Bmax di IGF-2R e IR alla nascita era inferiore nei vitelli prematuri rispetto a quella dei vitelli nati a termine. Le iniezioni di GH per 7 giorni hanno migliorato l’area cellulare della cripta, ma non le dimensioni dei villi del SI; Il GH non sembra stimolare rapidamente la crescita e lo sviluppo intestinale nei vitelli neonati. In studi precedenti, la somministrazione con l’alimento di IGF-1 umano ricombinante (che ha la stessa sequenza di amminoacidi dell’IGF-1 bovino) per 7 giorni ha migliorato l’inserimento della (3H)-timidina nel DNA degli enterociti isolati ex vivo, ma non sono state riportate informazioni sui cambiamenti morfologici. La somministrazione di una formula artificiale (contenente solamente tracce di sostanze non nutritivi) insieme a IGF-1 per via orale (latte derivato da conigli transgenici; quantità corrispondenti a quelle presenti nel colostro, ovvero 0.4 mg IGF-1/L formula) per 7 giorni non ha avuto effetti né sulla proliferazione delle cellule della cripta del SI né sulla crescita dei villi. Pertanto, l’IGF-1 ingerito in quantità fisiologiche presenti nel colostro, non è l’unico responsabile della crescita e dello sviluppo intestinale nei vitelli neonati. Nei vitelli si osserva un marcato assorbimento di IgG, lattoglobulina, albumina, lattoalbumina, ovoalbumina e Lf entro le prime 24–48 h dopo la nascita, mentre c’è un assorbimento inesistente o solamente trascurabile (e/o comparsa nella circolazione) di insulina, IGF-1, LR3-IGF-1 e PRL entro le prime 24 h dopo la nascita.
Effetti sistemici della nutrizione (sul metabolismo, sui sistemi endocrini e sullo status nutrizionale)
È noto che l’assunzione di colostro modifica lo status nutrizionale e immunitario (IgG) dei vitelli neonati. Sulla base dei nostri studi, dopo l’assunzione di colostro si verifica un aumento delle concentrazioni plasmatiche di IgG1, Lf, proteine totali, albumina, aminoacidi essenziali e un’impressionante diminuzione del rapporto glutammina/glutammato. Le concentrazioni plasmatiche di urea aumentano se vengono somministrate elevate quantità di colostro e le concentrazioni plasmatiche di glucosio aumentano con un ritardo di alcuni giorni; inoltre si osserva un aumento dei lipidi plasmatici (trigliceridi, fosfolipidi-lipidi, colesterolo totale e acidi grassi essenziali), del β-carotene e delle vitamine A ed E. Al contrario, non ci sono cambiamenti marcati o immediati per quanto riguarda i minerali o le concentrazioni plasmatiche di creatinina, lattato e nitrato. Visto che molte altre sostanze, in particolare proteine e peptidi oltre alle IgG1 vengono assorbite a livello intestinale e compaiono in circolo (come mostrato per Lf, che si ritrova anche nel liquido cefalorachidiano dei vitelli neonati), possiamo ipotizzare degli effetti funzionali.
Poiché l’assunzione di lattosio è insufficiente per mantenere le normali concentrazioni di glucosio plasmatico, la stimolazione della gluconeogenesi è importante e l’alimentazione con colostro ha fatto incrementare le concentrazioni plasmatiche di glucosio nei vitelli neonati, probabilmente a causa di un aumento delle attività gluconeogeniche epatiche chiave, ma le elevate concentrazioni di glucosio plasmatico dopo trattamento con desametasone (per simulare un elevato status neoglucogenico) non erano associate ad una stimolazione delle attività degli enzimi gluconeogenici epatici. Questo non vale solo per i vitelli neonati, ma può essere osservato anche nei vitelli con età maggiore . Tuttavia, le catecolamine sono probabilmente coinvolte nel metabolismo del glucosio e nella gluconeogenesi epatica dei vitelli neonati (e più anziani allattati con latte) sulla base dell’analisi dei livelli di mRNA e della Bmax dei recettori epatici α- e β-adrenergici. L’ingestione di colostro entro le prime 12 ore dopo la nascita è importante per le normali concentrazioni plasmatiche di β-carotene e di vitamine A ed E. Se alle vacche vengono somministrate integrazioni di vitamina A durante il periodo di asciutta, le concentrazioni di retinolo nel loro colostro e nel plasma dei loro vitelli risultano aumentate fino a 30 giorni dopo la nascita rispetto a quanto avviene per i vitelli partoriti da vacche che non hanno ricevuto un’integrazione di vitamina A durante l’asciutta. Ciò indica che un’assunzione precoce e sufficiente di vitamina A determina in larga parte il livello plasmatico della vitamina A. Nel momento in cui vitelli non vengono nutriti con colostro il primo giorno di vita, la diminuzione dell’assunzione e dell’assorbimento di acidi grassi essenziali, di vitamine liposolubili e di precursori (β-carotene, A, E) e i possibili cambiamenti nelle proteine di trasporto, potrebbero essere responsabili di un’alterazione dello status degli acidi grassi essenziali plasmatici, del β-carotene e delle vitamine A ed E. Invece, nei vitelli neonati i livelli plasmatici di 25(OH)D, 24,25(OH)2D e di 25,26(OH)2D (ma non quello di 1,25(OH)2D) dipendono dallo status della madre.
Contrariamente alle vitamine liposolubili, le vitamine B6, B12 e l’acido folico non dipendono dal momento temporale della prima somministrazione del colostro. Si evidenziano anche marcati cambiamenti nell’attività degli enzimi plasmatici, in particolare della γ-glutamiltransferasi, a seconda che il colostro venga o meno somministrato. Il digiuno nei vitelli appena nati (per 24 ore) causa cambiamenti metabolici più complessi rispetto a quanto succede nei vitelli di 1 settimana d’età. Non esistono prove di “imprinting” metabolico dovute a differenze nell’alimentazione somministrata immediatamente dopo la nascita. Durante la prima settimana di vita solitamente si verificano cambiamenti importanti nei livelli ematici degli ormoni che sono in parte associati all’alimentazione, come dimostrato per PRL, ormone adrenocorticotropo (ACTH), GH, IGF (e le loro proteine leganti 1–3), insulina, glucagone, leptina, tiroxina (T4), T3 e cortisolo. L’insulina e l’IGF-1 vengono appena assorbiti nell’intestino dei vitelli neonati, anche se somministrati in quantità farmacologiche, come nei suini neonati. Tuttavia, non possiamo escludere del tutto che si possano potenzialmente riscontrare situazioni in cui l’insulina e l’IGF-1 vengono assorbiti, come riportato per i suini. Inoltre, i vitelli neonati sono in grado di produrre IGF-1 poiché l’mRNA di IGF-1 è espresso nel fegato, nel GIT, nella milza, nel timo, nei linfonodi e nei reni. La somministrazione di GH bovino aumenta le concentrazioni plasmatiche di IGF-1 e si evidenziano cambiamenti significativi delle proteine leganti IGF 1–3 in risposta alle differenze di alimentazione e di trattamenti endocrini.
Sebbene l’asse GH-IGF-1 nei vitelli neonati sia sostanzialmente funzionale, il sistema non è completamente maturo visto che l’espressione epatica di IGF-1 nei vitelli neonati è ridotta e gli effetti del GH sui sistemi IGF sono notevolmente inferiori nei vitelli neonati rispetto ai bovini più anziani. La mancanza delle variazioni attese per i livelli di T4 e T3 nonostante le marcate differenze nell’assunzione di energia in molti dei nostri studi è in contrasto con Grongnet. Le concentrazioni plasmatiche di gastrina, polipeptide insulinotropico glucosio-dipendente e colecistochinina sono aumentate, mentre le concentrazioni di somatostatina e motilina sono diminuite. Le concentrazioni plasmatiche di cortisolo sono inferiori nei vitelli alimentati con colostro rispetto ai vitelli alimentati con latte artificiale. Non vi è alcuna influenza dell’alimentazione sui livelli di GH, degli ormoni tiroidei (T4, T3) e della PRL. Inoltre, non abbiamo prove di un “imprinting” endocrino dovuto a differenze di nutrizione nell’immediato periodo dopo la nascita.
Il presente articolo è una traduzione della ricerca Blum, J. W. (2006). Nutritional physiology of neonatal calves. Journal of animal physiology and animal nutrition, 90(1‐2), 1-11 in cui sono disponibili tutti i riferimenti bibliografici.








































































