Negli ultimi 40 anni l’Unione Europea (UE) ha raggiunto in materia di benessere animale standard tra i più elevati al mondo, tanto da essere riconosciuta tra i maggiori leader in questo ambito e da aver ispirato molte norme di paesi terzi. Tuttavia, nell’ambito degli animali di interesse zootecnico, gli ovini ed i caprini hanno subito un ritardo nella normativa a favore di altre specie, come bovini, suini e specie aviarie (es. Welfare QualityR, 2009a, Welfare QualityR, 2009b, Welfare QualityR, 2009c). Gli schemi di valutazione del benessere dei piccoli ruminanti, infatti, per anni si sono basati su principi generali comuni a tutte le specie di interesse zootecnico, senza la definizione di criteri e parametri specifici (Keeling, 2009). Una possibile ragione è attribuibile al caratteristico pascolamento, che contraddistingue i sistemi di allevamento di capre e pecore e che, in linea generale, fornisce maggiori garanzie di benessere rispetto alle realtà intensive. L’aumento di allevamenti intensivi e semi-intensivi e la presa di coscienza che anche nelle realtà estensive alcune delle classiche “cinque libertà” possono risultare limitate (Goddard et al., 2006), ha dato lo slancio per colmare la carenza di metodi specifici di monitoraggio del benessere.
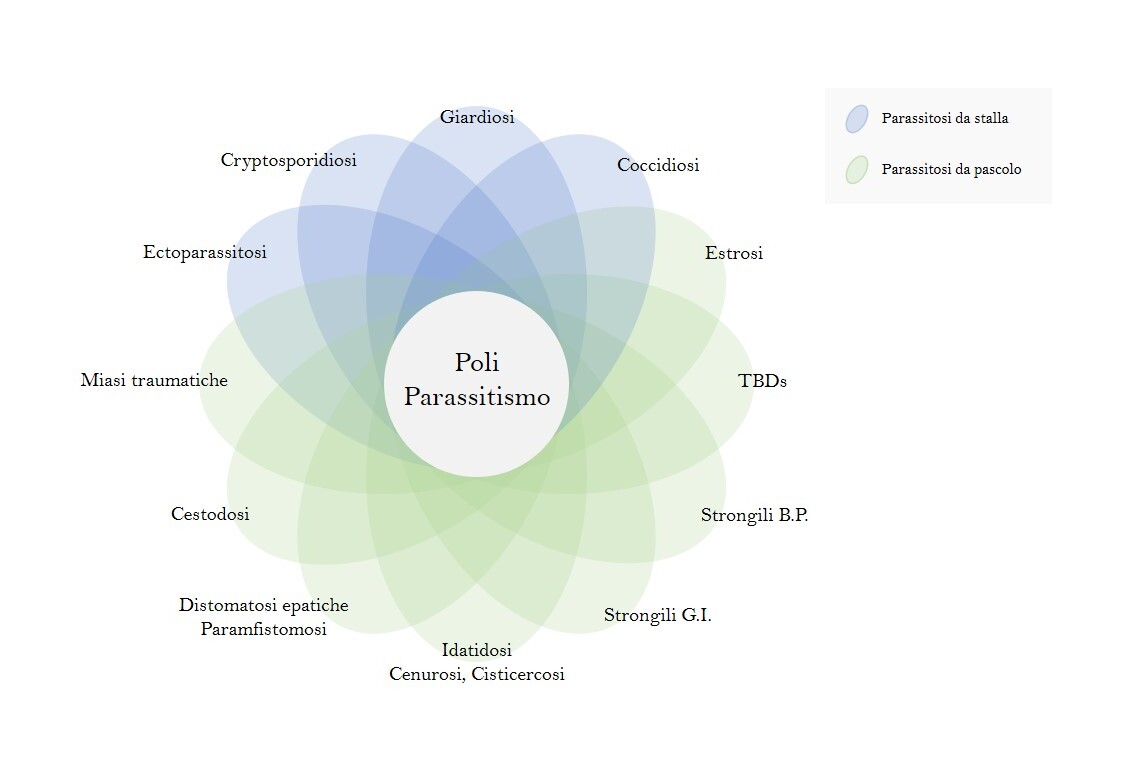
Le malattie parassitarie rappresentano una problematica ineluttabile all’interno del comparto zootecnico ovicaprino, indipendentemente dall’indirizzo produttivo e dai sistemi di allevamento e possono essere considerate delle autentiche tecnopatie (Ambrosi, 1995). I parassiti, infatti, sono in grado di sfruttare a loro vantaggio le criticità connesse alle varie tipologie di allevamento, modificando gli equilibri tra le differenti popolazioni con il prevalere di alcune specie su altre, conservando il generale stato di poliparassitismo. Nella seguente figura n. 1 sono riportate le più comuni parassitosi che caratterizzano il sistema di allevamento pastorale e stallino.
Figura 1 – Stato parassitario di pecore e capre in funzione dei sistemi di allevamento.
Il pascolo, se da un lato rappresenta un criterio gestionale fondamentale per la salute e il benessere dei piccoli ruminanti, in quanto elemento indispensabile per una corretta espressione della loro fisiologia e del corredo comportamentale, dall’altro però mostra delle criticità, tra cui spicca per importanza la difficoltà nel controllo delle parassitosi.
L’attività di pascolamento crea di fatto i presupposti per il mantenimento di circuiti epidemiologici di numerosi parassiti tra cui:
- parassiti a ciclo indiretto i cui ospiti intermedi invertebrati sviluppano ottimamente al pascolo (es. distomi epatici e gastrici, cestodi, Tick-Borne-Pathogens come Anaplasma phagocytophilum e piroplasmi, strongili bronco-polmonari BP));
- parassitosi sostenute da artropodi dal comportamento esofilo (es. estrosi nasofrontale, miasi traumatiche);
- parassitosi dal classico ciclo preda-predatore (es. cisticercosi, cenurosi cerebrale, idatidosi) per l’elevata esposizione alla predazione da parte di canidi selvatici o domestici che gravitano intorno ai greggi;
- parassiti a ciclo diretto che trovano nella fecalizzazione del pascolo il pabulum ottimale per lo sviluppo dei propri stadi larvali a vita libera (es. strongili gastro-intestinali (GI) e tricocefali).
Il pascolo inoltre favorisce parassiti dotati di elevata patogenicità, in quanto spesso le specie maggiormente patogene sono anche quelle dotate di più alti indici di prolificità (es. Haemonchus contortus) e che risentono in maniera ridotta del fattore diluente “pascolo”; infine, tende a selezione progressivamente popolazioni parassitarie resistenti (es. strongili GI, distomi epatici), per mancanza di trattamenti antiparassitari selettivi che mantengano quote di “refugia” (individui che conservano la suscettibilità agli antiparassitari) al pascolo.
L’allevamento stallino si caratterizza, di contro, per il prevalere di endo ed ectoparassitosi, come eimeriosi, criptosporidiosi, giardiosi, toxoplasmosi, pediculosi, rogne e melofagosi, le quali più frequentemente colpiscono categorie fragili come agnelli, capretti e rimonte, raggiungendo dei tassi di morbilità e in alcuni casi mortalità, nettamente più elevati rispetto a quelli osservati in animali gestiti al pascolo. Tali parassiti sono favoriti nel loro ciclo dall’elevata fecalizzazione ambientale, che consente la rapida infezione con forme di resistenza (cisti e oocisti) emesse direttamente o rapidamente infettanti, dalla presenza durante l’intero corso dell’anno di un’elevata pressione muscina, dalla possibilità di accesso da parte di roditori e gatti, nonché dal contatto stretto tra animali. E’ necessario considerare però che anche le parassitosi più tipicamente da pascolo, come quelle citate precedentemente, sono riscontrabili in ambiente controllato, seppure con frequenza ed intensità di infestazione più limitata, a motivo della persistente vitalità delle forme di resistenza sia nel fieno che negli insilati per un certo periodo (es. metacercarie, L3 di strongili GI).
I parassiti sono in grado di influire sul benessere a vari livelli ed attraverso meccanismi patogenetici differenti: danni meccanici e immunomediati ai tessuti, azione spoliatrice (es. sottrazione nutrienti essenziali, riduzione ingestione volontaria alimenti, alterazione digestione – assorbimento, alterazione metabolismo), ematofagia, stress, modulazione del sistema immunitario. Numerosi sono gli esempi di come infestazioni parassitarie possano limitare fortemente le “cinque libertà” del benessere animale; pensiamo ad A. phagocytophilum, patogeno trasmesso dalla zecca dura Ixodes ricinus, il cui effetto depressante predispone capretti ed agnelli a gravi infezioni batteriche come la piemia; immaginiamo il timore e stress che subiscono le pecore che pascolano in presenza di agenti miasigeni quali Wohlfahrtia magnifica o Oestrus ovis o il distress termico subito da animali affetti da rogna psoroptica che, portando ad una perdita pressoché completa del vello, espone la cute al freddo o al caldo eccesivo, oltreché a lesioni traumatiche etc.
Lo stato parassitario degli animali diventa a tutti gli effetti un parametro di benessere da sottoporre a monitoraggio attraverso precisi indicatori; a testimonianza di ciò, le numerose linee di intervento che nell’ambito dei bandi di attuazione della misura 14 del benessere animale dei Piani di Sviluppo Rurale (PSR) regionali mirano a migliorare le condizioni parassitarie di allevamenti ovini e caprini in Italia, ponendolo come requisito essenziale per usufruire dei premi regionali.
L’eliminazione delle malattie parassitarie dalle realtà zootecniche rappresenta un’opzione irrealistica, come dimostrano le esperienze dei piani di eradicazione dell’echinococcosi/idatitosi messi in atto tra il 1962 ed il 1987 in Sardegna, i quali, pur tenendo conto di tutti gli aspetti fondamentali del circuito epidemiologico della parassitosi e mettendo in atto linee di intervento a tutti i livelli, sono falliti.
Tra i limiti principali:
- scarsa percezione delle malattie parassitarie, vista la ridotta morbilità che in generale le caratterizza e l’assenza di segni clinici specifici. L’assenza di malattia dipende dalla condizione di resilienza (tolleranza da parte degli animali del parassita e sua patogenicità) e non coincide tuttavia con uno stato di pieno benessere e salute dell’animale, dal momento che l’effetto patogeno è insito nel concetto di parassita;
- inefficaci sistemi di monitoraggio dello “status” parassitario basati nella maggior parte dei casi unicamente su esami coprologici condotti con criteri di campionamento non standardizzati per tempistica e consistenza numerica;
- controllo parassitario basato prevalentemente o esclusivamente sull’utilizzo di antiparassitari somministrati a tappeto.
Rispetto ai sistemi di monitoraggio, è necessario considerare che la valutazione corretta del rischio parassitologico all’interno di un allevamento non può basarsi unicamente sul ricorso ad esami coprologici di tipo qualitativo (es. concentrazione per flottazione, sedimentazione, coprocolture, test di Baermann), così come messo in atto frequentemente nei PSR. Tale approccio infatti è in grado di rilevare la presenza esclusiva di endoparassiti patenti a sede gastro-intestinale, polmonare o epatica ed esclude totalmente la ricerca gli ectoparassiti (es. zecche, agenti di rogna ecc), parassiti viscerotropi (es. Toxoplasma gondii, Sarcocystis spp.) o a tropismo ematico (es. A. phagocytophilum, piroplasmi) o parassiti in fase di pre-patenza (es. Telodorsagia spp., Fasciola hepatica).
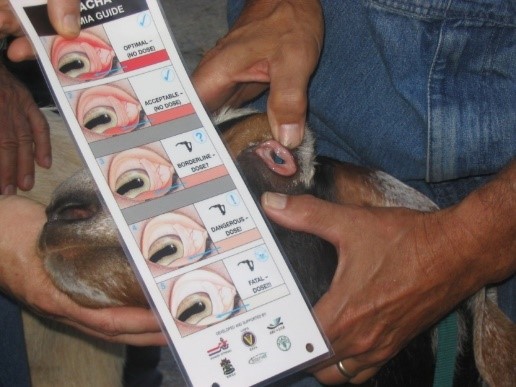
La diagnostica copromicroscopica qualitativa resta il primo approccio nell’ambito della diagnosi delle parassitosi, ma va integrata con metodiche di tipo quantitativo (es. McMaster, tecniche FLOTAC) (Cringoli et al., 2010) al fine di valutare i livelli di escrezione (Faecal Egg/Oocyst/Larval Counts), che per alcuni parassiti sono fondamentali per definire strategie di trattamento selettivo, ed a raschiati cutanei, indagini sierologiche e valutazioni al macello. I criteri di campionamento dovrebbero essere chiaramente definiti e tenere conto della rappresentatività del gregge (almeno 10 animali, omogeneità di età, sesso, stato riproduttivo). I risultati ottenuti dovrebbero essere interpretati alla luce di valutazioni produttive del gregge (es. BCS medio degli animali, incrementi ponderali, produzione quantitativa e qualitativa del latte), valutazioni cliniche degli animali soprattutto rispetto a segni quali anemia, perdita di peso, presenza di edema intermandibolare. Potrebbe essere utile nelle aziende dove è presente H. contortus anche il ricorso al sistema FAMACHA© (Figura n. 2), attualmente non commercializzato in Italia, che stima il carico parassitario sulla base del livello (grade 1-5) di anemia delle mucose con un’ottima corrispondenza.
Figura 2 – Tecnica FAMACHA© applicata per valutare il grado di infestazione e la necessità di trattamento terapeutico (grade 3-5).
Il ricorso terapeutico e profilattico a farmaci antiparassitari resta purtroppo la principale misura di controllo delle parassitosi del comparto ovicaprino, con tutte le problematiche connesse all’impatto dei residui degli antiparassitari sull’ecosistema (es. alterazione delle catene trofiche di terra, acqua e atmosfera da parte di Lattoni Macrociclici, Triazoni, Piretroidi) e sui prodotti alimentari; dell’interferenza sullo sviluppo della immunità naturale contro i parassiti e dello sviluppo di resistenza, sempre più diffusa tra le popolazioni elmintiche (strongili GI, F. hepatica) ed in aumento anche tra quelle di ectoparassiti (es. Psoroptes ovis, Bovicola ovis). Quest’ultimo aspetto risulta di primaria importanza dal momento che nel mercato farmaceutico internazionale non è in previsione l’immissione di nuove molecole ad attività antiparassitaria destinate a pecore e capre. Preservare popolazioni parassitarie suscettibili (refugia) risulta pertanto fondamentale.
Tale obiettivo è perseguibile attraverso le seguenti pratiche:
- ottimizzazione dei trattamenti, evitando errori gestionali dei farmaci (vedi Specchietto 1);
- trattamenti selettivi per strongili GI basati sulle FEC (es. upg < 300 upg trattamento non strettamente necessario; > 1000 upg SGI trattamento decisamente necessario; 300-1000 upg trattamento da effettuarsi sulla base di ulteriori valutazioni);
- trattamenti e prevenzione mirata alle problematiche parassitarie predominanti e agli stadi biologici più patogeni, limitando l’utilizzo di prodotti a largo spettro (es. Triclabendazolo per trattamenti adulticidi contro F. hepatica, Ivermectina per rogne superficiali) e prediligendo, quando possibile, farmaci a spettro più ridotto (es. Closantel per H. contortus);
- monitoraggio dell’efficacia dei trattamenti, almeno su base annuale, attraverso Faecal Eggs Counts Reduction Test (FECRT) o, nel caso di alcuni antiparassitari come i benzoimidazolici, anche attraverso l’utilizzo di test in vitro quali EHA (Eggs Hatch Assay) e LDA (Larval Development Assay) (Simpragra et al., 2015).
Purtroppo, il sovrautilizzo nel tempo di farmaci antiparassitari, anziché essere smorzato è andato anzi rafforzandosi, come dimostra l’ampio utilizzo degli antiparassitari nel biologico un tempo limitato dal Regolamento UE n. 2092/91 e 1804/99 che riduceva il n. di trattamenti consentiti, con la scelta di molecole a basso impatto ambientale, metabolizzazione rapida, tossicità ridotta e con tempi di sospensione inferiori a 10 giorni. Il Regolamento UE n. 889/2008, abolendo tali limitazioni, ha promosso un uso di antiparassitari chimici nel biologico al pari delle aziende convenzionali.
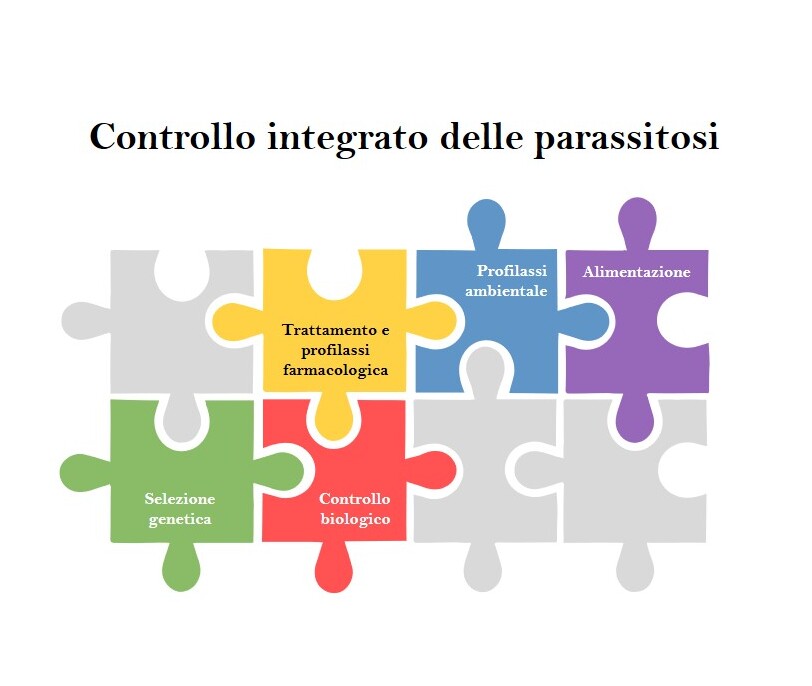
Per il futuro risulta quanto mai auspicabile avviare piani di lotta integrata che riducano la dipendenza dagli antiparassitari attraverso misure di profilassi ambientale (vedi Specchietto n. 2), controllo biologico (es. utilizzo di funghi nematofagi-Duddingtonia flagrans), utilizzo in alimentazione di foraggi bioattivi (es. tannini, terpeni, flavonoidi) (Brogna et al., 2014) e selezione genetica di razze resistenti agli strongili GI (es. razze merinizzate in Nuova Zelanda e Australia) (Al Kalaldeh et al., 2019) (Figura n. 3).
Figura 3 – Schema di approccio integrato al controllo delle parassitosi di capre e pecore.
Il contenuto di questo articolo si riferisce alla relazione presentata nel corso del webinar “Aggiornamenti sul benessere negli ovini e nei caprini”, organizzato dalla Società Italiana di Patologia e di Allevamento degli Ovini e dei Caprini (SIPAOC). La registrazione integrale del webinar è disponibile sul sito della SIPAOC (www.sipaoc.it).
Autori:
Fabrizia Veronesi e Manuela Diaferia – Dipartimento di Medicina Veterinaria, Università degli Studi di Perugia.
Bibliografia
- Al Kalaldeh M., Gibson J., Lee S.H., Gondro C., van der Werf J.H.J. 2019. Detection of genomic regions underlyin resistance to gastrointestinal parasites in Australian sheep. Genet. Sel. Evol., 3; 51 (1):37.
- Ambrosi M. 1995. Parassitologia Zootecnica. Edagricole.
- Brogna D.M.R., Tansawat R., Cornforth D., Ward R., Bella M., Luciano G., Priolo A., Villalba J. 2014. The quality of meat from sheep treated with tannin- and saponin-based remedies as a natural strategy for parasite control. Meat Sci., 96 (2 PtA): 744-749.
- Cringoli G., Rinaldi L., Maurelli MP., Utzinger J. 2010. FLOTAC: New multivalent techniques for qualitative and quantitative copromicroscopic diagnosis of parasites in animals and humans. Nature protocol 5 (3): 503-515.
- Goddard P., Waterhouse T., Dwyer C., Stott A. 2006. The perception of the welfare of sheep in extensive systems. Small Rum. Res., 62, 215-225.
- Keeling L. 2009. An overview of the development of the Welfare Quality Project Assessment System. Welfare Quality Reports No.12, SLU Service, Uppsala, Sweden, 97.
- Simpragra M., Hlede J.P., Shek Vugrovecki A., Marinculic A., Tralcci S. 2015. Alternative approaches for control of gastrointestinal nematoda in sheep farming: a review. Berli Munch Tierarztl Wochenschr, 128 (7-8): 257-270.
- Welfare Quality® (2009a). Assessment protocol for cattle. NEN, The Netherlands, 182.
- Welfare Quality® (2009b). Assessment protocol for pigs. NEN, The Netherlands, 122.
- Welfare Quality® (2009c). Assessment protocol for poultry. NEN, The Netherlands, 114.