Abstract
Introduzione
Fattori che influenzano la composizione del latte
Latte Convenzionale Versus Latte Biologico: principali Componenti
- Produzione di latte
- Contenuto di grasso del latte
- Grassi del latte – singoli acidi grassi
- Contenuto di proteine del latte
- Contenuto di lattosio nel latte
- Riassunto delle principali componenti
Latte Convenzionale Versus Latte Biologico: acidi grassi
- Latte proveniente dalla vendita al dettaglio e dai caseifici
- Latte proveniente dai gruppi di ricerca e dagli allevamenti da latte
Latte Convenzionale Versus Latte Biologico: componenti minori
Latte Convenzionale Versus Latte Biologico: altri aspetti
Conclusioni
Ringraziamenti
Riferimenti
B. H. Schwendel,*1 T. J. Wester,* P. C. H. Morel,* M. H. Tavendale,† C. Deadman,‡ N. M. Shadbolt,§ e D. E. Otter#
*Institute of Veterinary, Animal and Biomedical Sciences, Massey University, Tennent Drive, Palmerston North 4474, Nuova Zelanda.
†Animal Nutrition and Health, AgResearch Grasslands Research Centre, Tennent Drive, Palmerston North 4442, Nuova Zelanda.
‡Fonterra Research Centre Palmerston North, Dairy Farm Road, Palmerston North 4442, Nuova Zelanda.
-
Institute of Agriculture and Environment, Massey University, Tennent Drive, Palmerston North 4474, Nuova Zelanda.
#Food and Bio-based Products, AgResearch Grasslands Research Centre, Tennent Drive, Palmerston North 4442, Nuova Zelanda.
Ricevuto il 20 Maggio 2014; Accettato il 29 Ottobre 2014.
1Autore corrispondente: heike.schwendel@agresearch.co.nz
Abstract
I consumatori hanno una percezione del latte vaccino biologico correlata al presupposto che tale latte differisca dal latte convenzionale. L’importanza data a questa differenza giustifica l’elevato prezzo di vendita al dettaglio del latte biologico. Tra i consumatori spicca la percezione che l’agricoltura biologica sia più rispettosa dell’ambiente, degli animali e delle persone; che i prodotti lattiero-caseari biologici siano prodotti senza l’utilizzo di antibiotici, l’aggiunta di ormoni, di prodotti chimici di sintesi e che non siano geneticamente modificati; e che possano avere potenziali benefici per la salute umana. Gli studi controllati che analizzano l’esistenza di eventuali differenze tra il latte biologico e quello convenzionale sono risultati finora in gran parte equivoci, principalmente a causa della complessità della tematica della ricerca e dell’elevato numero di fattori che possono influenzare la composizione del latte stesso. Una delle complicazioni principali è relativa al fatto che le pratiche allevatoriali e i loro effetti variano, tra sistemi biologici e convenzionali, a seconda del paese, della regione, dell’anno e della stagione. Sono stati studiati singolarmente quei fattori che influenzano la composizione del latte (ad esempio, dieta, razza e stadio di lattazione), mentre le interazioni tra i numerosi fattori sono state ampiamente ignorate. Studi che non tenevano conto del fatto che altri aspetti, diversi dal sistema di allevamento (biologico o convenzionale), potessero aver causato o contribuito alle differenze riportate sulla composizione del latte, rendono impossibile determinare la reale esistenza di una diversità tra latte biologico e convenzionale attribuibile al sistema di allevamento. La composizione degli acidi grassi del latte è stata un’area di ricerca centrale durante il confronto tra latte biologico e latte convenzionale, soprattutto perché il profilo degli acidi grassi risponde rapidamente, ed è molto sensibile, ai cambiamenti della dieta. Di conseguenza, è l’effetto delle pratiche allevatoriali (input elevato vs. input basso), piuttosto che il sistema di allevamento (biologico vs. convenzionale), che va a determinare il profilo degli acidi grassi del latte, e risultati analoghi si osservano per il latte biologico a basso input e quello convenzionale sempre a basso input. Questo confonde la nostra capacità di sviluppare un metodo analitico utile a distinguere il latte biologico da quello convenzionale per consentire un controllo del prodotto. La mancanza di una ricerca sulle interazioni tra i diversi fattori influenti e le differenze nella complessità della sperimentazione e nell’uniformità tra gli studi (per quanto concerne, ad esempio, il periodo di campionamento, le dimensioni del campione, il rendiconto delle modalità della sperimentazione) complicano l’interpretazione dei dati e ci impediscono di trarre delle conclusioni univoche. La prima parte di questa review fornisce una sintesi dettagliata dei singoli fattori che notoriamente influenzano la composizione del latte. La seconda parte presenta una panoramica degli studi che hanno messo a confronto il latte biologico e quello convenzionale, e discute i risultati nell’ambito dei vari fattori presentati nella prima parte.
Parole chiave: latte biologico, composizione del latte, pascolo, acidi grassi del latte
Introduzione
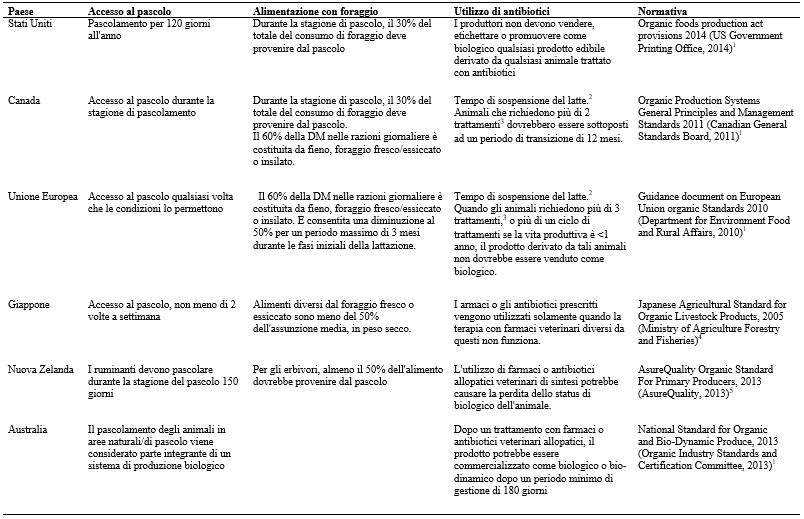
La composizione del latte bovino è influenzata da molteplici fattori legati al singolo animale o all’ambiente in cui vive. Elementi quali la dieta (Ferlay et al., 2008; Larsen et al., 2010), la razza (Soyeurt et al., 2006; Palladino et al., 2010), la genetica del singolo animale (Soyeurt et al., 2008), lo stadio di lattazione (Craninx et al., 2008; Stoop et al., 2009), il management (Coppa et al.., 2013) e la stagione (Heck et al., 2009), così come le interazioni tra i vari soggetti (Macdonald et al., 2008; Piccand et al., 2013; Stergiadis et al., 2013), influenzano la composizione del latte e molti dei meccanismi alla base dei loro effetti non sono stati ancora pienamente compresi. Pertanto, quando si cerca di studiare l’effetto di un fattore specifico (ad esempio, la dieta) sulla composizione del latte vaccino, è necessario eliminare gli altri fattori condizionanti. Quelli che non possono essere eliminati devono essere tenuti in considerazione e i loro effetti devono essere presi in esame e ridotti al minimo. Attualmente, non ci sono prove del fatto che il consumo di alimenti biologici apporti significativi benefici nutrizionali per la salute umana (Forman et al., 2012; Załecka et al., 2014). Presunti studi che confrontano il latte biologico con il latte convenzionale sono pieni di complicazioni. Per poter determinare se il latte biologico differisca dal latte convenzionale, tutti i fattori che influenzano la composizione del latte dovrebbero essere identici, eccezione fatta per quei fattori che definiscono nello specifico il sistema di allevamento impiegato (biologico o convenzionale). Qualora il sistema di allevamento differisse nei campioni di latte confrontati, risulterebbe difficile determinare se i risultati fossero una derivazione della differenza che intercorre tra i sistemi di allevamento o se fossero la conseguenza di altri fattori. Review più recenti (Magkos et al., 2003; Dangour et al., 2010; Guéguen e Pascal, 2010; Smith-Spangler et al., 2012) hanno evidenziato la mancanza di un “vero” confronto negli studi che valutavano la produzione biologica e convenzionale degli alimenti (latte e latticini inclusi). Molti studi che confrontano il latte biologico con quello convenzionale sono inadeguati quando discutono i fattori che effettivamente sono alla base dei risultati che presentano. Comunemente, i fattori che potrebbero aver contribuito alle differenze riportate (tra latte biologico e convenzionale) non vengono presi in considerazione (ad esempio, differenze nella dieta, nella razza e nella salute degli animali). La maggior parte degli studi che effettuavano un confronto tra latte biologico e convenzionale prevedeva diete che variavano per quanto riguarda la quantità di foraggio fresco e di concentrato somministrati a bovine allevate secondo metodi biologici e a bovine allevate in maniera convenzionale. Di conseguenza, i risultati presentati molto probabilmente erano correlabili agli effetti attribuibili a diete differenti, piuttosto che al fatto che le vacche consumassero mangimi biologici o convenzionali. Per contro, gli studi che indicavano specifiche differenze di produzione tra latte biologico e convenzionale (ad esempio, una maggiore quantità di pascolo nella dieta delle vacche biologiche) non tenevano conto dell’influenza del sistema di allevamento (biologico o convenzionale) sui loro risultati (Palupi et al., 2012). Inoltre, i confronti tra gli studi sono problematici perché è difficile tenere conto di qualsiasi variabile, comprese le condizioni di campionamento (ad esempio, frequenza di campionamento, tempo di campionamento, campioni prelevati da singole vacche vs. latte di massa vs. molteplici aziende), le differenze intrinseche nei sistemi di allevamento tra le regioni, i livelli di input e persino le differenze normative che si hanno nella produzione convenzionale e biologica tra le varie nazioni. I regolamenti da applicare all’allevamento biologico di bovini da latte, sebbene simili in linea di principio, nel dettaglio variano da un paese all’altro (ad esempio, per quanto riguarda l’accesso ai pascoli e l’utilizzo di antibiotici) (tabella 1). Pertanto, l’eterogeneità di tali regolamenti potrebbe contribuire alla diversità della composizione del latte biologico tra i paesi. I problemi sopra descritti spiegano l’incapacità degli studi precedenti di raggiungere un consenso sull’esistenza o meno di differenze di composizione tra i prodotti lattiero-caseari biologici e quelli convenzionali.
Tabella 1. Normative paese-specifiche per l’allevamento biologico relative all’accesso al pascolo, all’alimentazione con i foraggi e all’utilizzo degli antibiotici.
1 Gli standard in uso per il bestiame biologico sono obbligatori per i produttori.
2 Tempo di sospensione del latte = almeno 30 giorni o 2 volte il tempo di sospensione specifico del farmaco, comunque più lungo.
3 Trattamenti = combinano antiparassitari ed antibiotici all’anno.
4 Gli standard per il bestiame biologico sono volontari per i produttori.
5 Alcuni standard per il bestiame biologico, i quali sono volontari e scelti dagli allevatori in base alla loro tipologia di produzione biologica.
Di conseguenza, la messa a confronto degli studi di ricerca dovrebbe essere intrapresa con la consapevolezza che fattori specifici dello studio potrebbero avere un effetto significativo sulla produzione degli animali e sulla composizione del latte e potrebbero contribuire alle differenze segnalate. Questa review si concentra sulla composizione chimica del latte bovino e riassume l’ampia gamma delle diverse componenti del latte analizzate in relazione alla loro presenza quantitativa e qualitativa nel latte biologico e convenzionale. L’obiettivo è anche quello di mostrare come le diverse componenti del latte vengano influenzate da una molteplicità di fattori individuali e dalle interazioni tra di essi, e come le variazioni che ne derivano possano essere percepite come differenze tra latte biologico e convenzionale. Questo rafforza il fatto che tali fattori devono essere tenuti in considerazione durante la valutazione degli studi esistenti o durante la progettazione di esperimenti comparativi. Le differenze tra i metodi di produzione biologico e convenzionale hanno inoltre creato discrepanze che ad oggi hanno impedito lo sviluppo di un metodo utile per testare l’autenticità dei prodotti lattiero-caseari biologici. È inclusa anche una breve discussione sui test proposti per l’identificazione dei prodotti biologici.
Fattori che influenzano la composizione del latte
Numerosi e differenti fattori influenzano la produzione e la composizione del latte. Tali elementi, idealmente, dovrebbero essere controllati quando si conduce uno studio che abbia l’obiettivo di esaminare i fattori in grado di modificare la composizione del latte. Questi fattori potrebbero sembrare relativamente secondari, ma potrebbero essere responsabili di una parte significativa della variabilità. Uno studio condotto da Roche et al. (2009), tra il 1995 e il 2001, ha dimostrato che l’impatto combinato del clima, della qualità e della concentrazione minerale delle erbe era responsabile fino ad un 22% della variazione nella produzione dei bovini da latte. Durante un trial diverso, Roesch et al. (2005) hanno confrontato le performance di bovine provenienti da sistemi di allevamento biologico ed integrato ed hanno riscontrato che la produzione di latte era correlata positivamente alla razza (specialmente Holstein), all’alimentazione con concentrati, al quotidiano dipping dei capezzoli e ad una maggior possibilità di accesso esterno durante l’inverno, indipendentemente dal sistema. Essi hanno concluso che una minore produzione di latte (nelle vacche in allevamento biologico e integrato) è la risultante di fattori appartenenti ai singoli animali e a livello di azienda, come la razza, l’alimentazione, il management e la salute della mammella. Uno studio condotto da Waiblinger et al. (2002), che analizzava 30 piccole aziende da latte a conduzione familiare, ha concluso che la produzione di latte era inferiore in quelle aziende dove era presente una gestione negativa dell’interazione tra il personale e le bovine durante la mungitura.
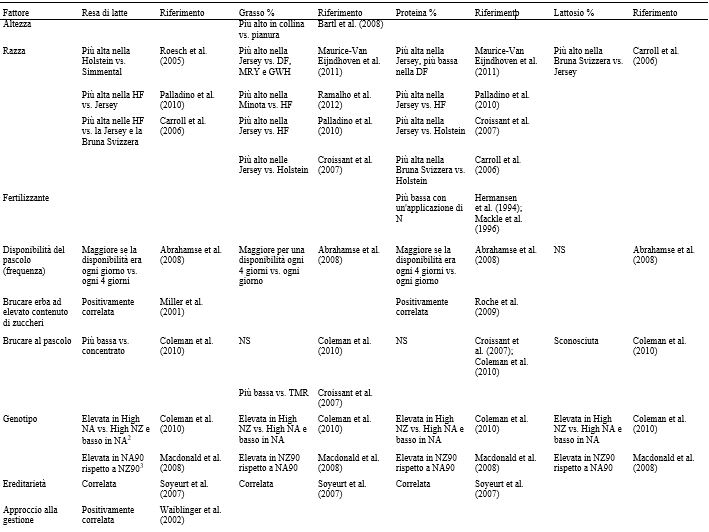
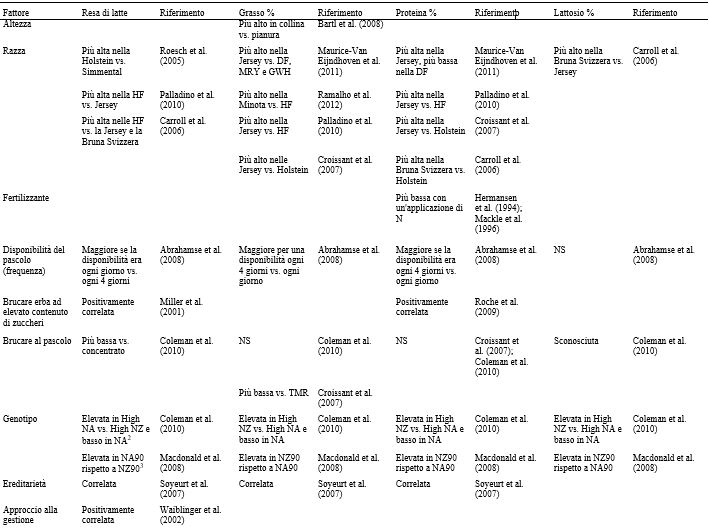
Tabella 2. Riassunto dei fattori che influenzano le resa di latte e le concentrazioni di grasso, proteina e lattosio1
Clicca sulla tabella per ingrandire.
1 DF = Frisona Olandese; MRY = Meuse-Rhine-Yssel; GWH = Groningen White Headed; HF = Holstein-Friesian.
2 Basso NA = merito genetico medio nazionale North American Holstein-Friesian; elevato NA = merito genetico elevato North American Holstein-Friesian; elevato NZ = merito genetico elevato New Zealand Holstein-Friesian.
3 NZ90 = elevato Breeding Worth Holstein-Friesian of New Zealand del 1990; NA90 = elevato Breeding Worth Holstein-Friesian of North American del 1990.
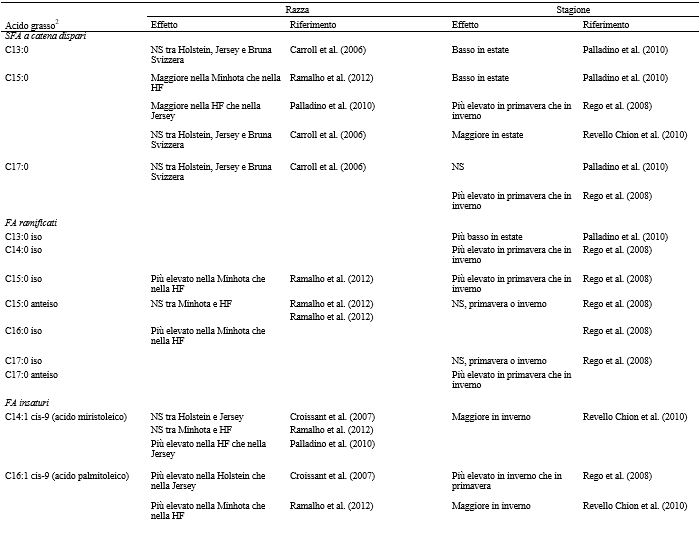
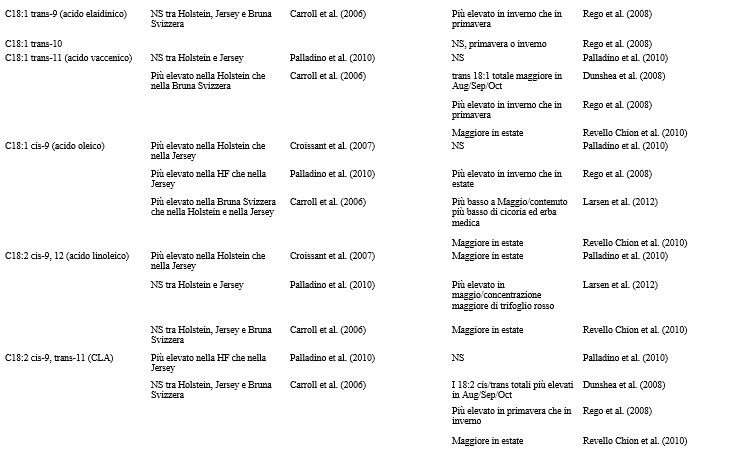
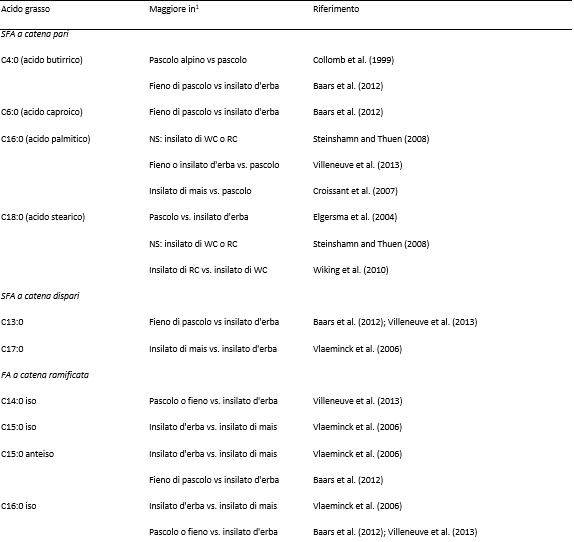
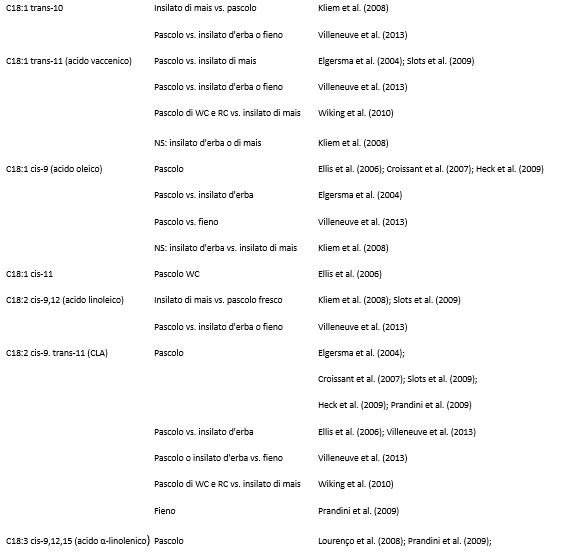
Nella Tabella 2 sono riportati i vari fattori che influenzano la produzione di latte, così come la concentrazione di grassi, proteine e lattosio, a livello di azienda e di singolo animale. I fattori ritenuti più influenti, tuttavia, possono variare a seconda delle condizioni e degli obiettivi dello studio. La fase della lattazione, ad esempio, può essere trascurata quando si raccolgono campioni di latte di massa da un allevamento con un sistema di parti tutto l’anno, ma diventa significativa quando si prelevano campioni di latte dai singoli animali o quando viene praticato il parto in blocco (Nantapo et al., 2014). Così come i principali fattori influenti vengono presi in considerazione e controllati (ad esempio, le vacche coinvolte in un test sono tutte di una sola razza, con genetica simile, allo stesso stadio di lattazione, alimentate con diete simili), anche quei fattori considerati in precedenza minori (ad esempio, la composizione del pascolo) diventano più importanti. L’analisi e la (potenziale) alterazione della composizione dei FA ( Fat Acid, acidi grassi) del latte sono punti chiave della ricerca lattiero-casearia, vista la rapida risposta del profilo dei FA ai cambiamenti della dieta. Altri fattori che influenzano la composizione dei FA del latte sono la razza, lo stato energetico, lo stadio di lattazione, la salute della mammella e la stagione. Quest’ultimo fattore riflette maggiormente i cambiamenti della dieta, specialmente quando questa è ricca di foraggio. La composizione chimica e botanica dei foraggi freschi varia a seconda delle stagioni e la conservazione del fieno o degli insilati influisce sul valore nutrizionale dei foraggi. Il passaggio stagionale delle bovine da latte dal pascolo alla stabulazione al chiuso, e il conseguente cambiamento della dieta, può essere osservato nella composizione del latte (Larsen et al., 2010; Kuczyska et al., 2012). Gli effetti sulla composizione del grasso del latte attribuibili alla razza e alla stagione sono riassunti nella Tabella 3, mentre gli effetti dei diversi foraggi sui FA del latte sono elencati nella Tabella 4.
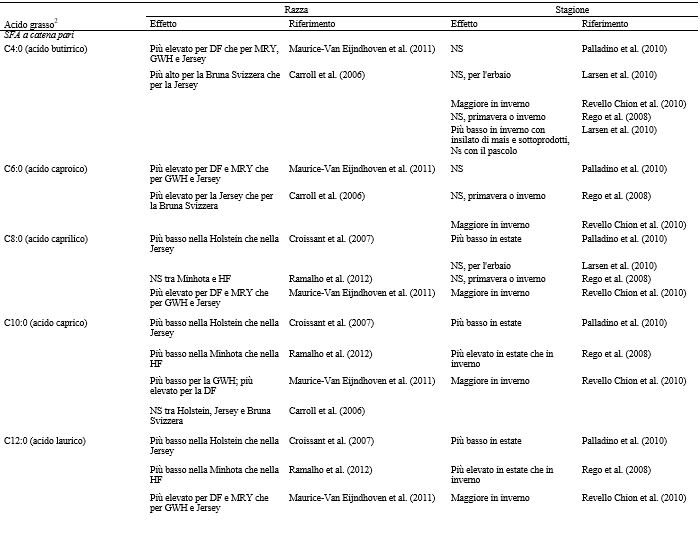
Tabella 3. Effetto della stagione e della razza sui singoli acidi grassi del latte1
1 DF = Frisona Olandese; MRY = Meuse-Rhine-Yssel; GWH = Groningen White Headed; HF = Holstein-Friesian.
Tabella 4. Effetto dei diversi foraggi sui singoli acidi grassi del latte
1 WC = trifoglio bianco; RC = trifoglio rosso.
Latte Convenzionale Versus Latte Biologico: principali componenti
Produzione di latte
Nonostante l’esistenza di allevamenti biologici altamente specializzati, basati sul pascolo, con bovine che producono più di 9.000 kg di latte all’anno (Muller-Lindenlauf et al., 2010), tendenzialmente la produzione di latte nelle bovine allevate con metodo biologico è in media inferiore a quella delle vacche allevate secondo metodiche convenzionali (Sundberg et al., 2009). Queste differenze sono significative, con le mandrie biologiche che raggiungono l’85% (range: dal 72 al 91%) delle rese registrate per le mandrie convenzionali (Bilik e al., 2009). Lopuszanska-Rusek, 2010; Müller e Sauerwein, 2010; Stiglbauer et al., 2013). La diminuzione della produzione nell’allevamento biologico può essere ricondotta ad un minore apporto energetico, dovuto sia ad un minor apporto di concentrato (Garmo et al., 2010; Stiglbauer et al. 2013), sia ad un minore contenuto energetico dei foraggi provenienti da aziende biologiche. Questo viene esemplificato da Gruber et al. (2001), che hanno condotto uno studio della durata di 6 anni impiegando diete quasi identiche per bovine biologiche e convenzionali. Essi hanno dimostrato che la produzione di latte per vacca e per anno era identica in entrambe le mandrie, ma la produzione di latte per area di pascolo era minore nella mandria biologica a causa delle basse rese in DM dei pascoli biologici e, di conseguenza, dei minori tassi di densità per ettaro. Di conseguenza, diete simili nella composizione e nel contenuto di ME hanno avuto lo stesso effetto sulla produzione di latte, indipendentemente dal fatto che il sistema di allevamento fosse biologico o convenzionale.
Contenuto di grasso del latte
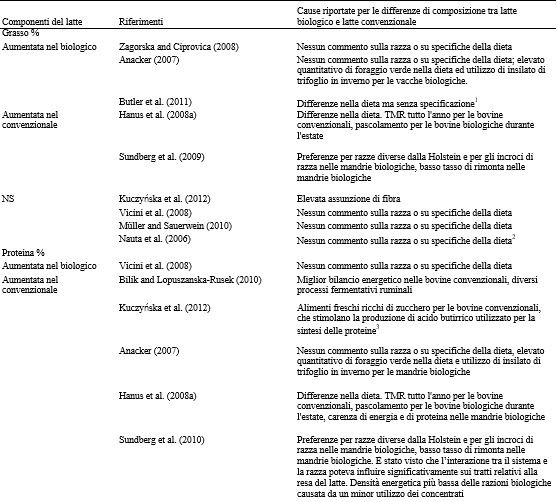
I risultati di studi di ricerca che analizzano il contenuto di grassi nel latte biologico e in quello convenzionale sono ambigui. Zagorska e Ciprovica (2008) e Anacker (2007) hanno riscontrato un aumento del contenuto di grassi nel latte biologico, mentre studi condotti da Sundberg et al. (2009), Hanus et al. (2008b), e Kuczyska et al. (2012) hanno osservato una maggiore percentuale di grassi nel latte convenzionale. Campioni di latte venduto al dettaglio, raccolti nei mesi di ottobre e novembre 2006 negli Stati Uniti, non hanno mostrato differenze significative nella percentuale di grasso tra le due tipologie di latte (Vicini et al., 2008). Questo risultato potrebbe essere dovuto all’applicazione degli standard federali relativi al contenuto di materia grassa nei prodotti a base di latte fluidi. Nel 2002 e nel 2004, Müller e Sauerwein (2010) hanno analizzato campioni di latte di massa proveniente da 35 allevamenti biologici e da 33 allevamenti convenzionali ed hanno segnalato una quantità simile di grassi nel latte nei due sistemi di allevamento. Le ragioni delle differenze segnalate possono essere varie, con poche pubblicazioni che menzionano le potenziali cause. Una maggior concentrazione di grassi nel latte proveniente da allevamenti biologici, rispetto agli allevamenti convenzionali, potrebbe essere legata al fatto che negli allevamenti biologici vengono preferite bovine di razza non Holstein (Nauta et al., 2009), con conseguente aumento del numero di bovine razza Jersey e di altre razze (Palladino et al., 2010). Un incremento nella somministrazione di concentrati a base di amido è stato associato ad una diminuzione della concentrazione dei grassi nel latte. Quantità maggiori di concentrati a base di amido vengono comunemente impiegate nelle diete delle vacche da latte allevate in modo convenzionale (Rosati e Aumaitre, 2004), perché le normative dell’allevamento biologico limitano l’impiego dei concentrati. In alternativa, un aumento della percentuale di grassi nel latte proveniente da allevamenti convenzionali potrebbe indicare una dieta arricchita con integratori di grassi (Vyas et al., 2012; Lock et al., 2013). Un bilancio energetico negativo, riscontrato prevalentemente durante le fasi iniziali della lattazione e nel periodo invernale nelle bovine biologiche a basso input (Trachsel et al., 2000), potrebbe influire anche sulla percentuale di grasso nel latte (Gross et al., 2011). Inoltre, una media più alta di parti gemellari (Craninx et al., 2008), variazioni nell’ereditarietà (Soyeurt et al., 2007) e il genotipo (Coleman et al., 2010) potrebbero influire nella percentuale di grasso del latte. Questi trials sperimentali con risultati inadeguati fanno si che le conclusioni ottenute da questi studi debbano essere interpretate con cautela. La Tabella 5 raccoglie diversi studi nei quali sono stati messi a confronto il contenuto di grassi, di proteine e di lattosio del latte biologico e di quello convenzionale, ed elenca le cause riportate (secondo l’opinione degli autori) delle eventuali differenze.
Grassi del latte – singoli acidi grassi
In linea generale l’effetto dei grassi del latte vaccino sulla salute umana non può essere descritto come positivo o negativo, e la funzione biologica di ciascun acido grasso deve essere considerata singolarmente (Arnold e Jahreis, 2011). Tuttavia, buona parte dell’attuale ricerca è focalizzata sul tentativo di modificare la composizione degli AG (acidi grassi) del latte al fine di creare un profilo che sia considerato più desiderabile per la salute umana. Due approcci comuni prevedono di influenzare la composizione degli AG del latte mediante cambiamenti della dieta o tramite la selezione genetica di vacche con un profilo di AG del latte maggiormente desiderabile (Bilal et al., 2012). Un più basso apporto di acidi grassi omega-6 rispetto agli omega-3, ad esempio, è benefico per la salute umana. Solitamente, la quantità di AG n-6 nelle diete occidentali è troppo elevata, con possibili conseguenze negative (ad esempio, malattie cardiovascolari, cancro e malattie infiammatorie e autoimmuni; Simopoulos, 2003). Le attuali raccomandazioni riguardanti il rapporto dietetico tra gli acidi grassi n-6:n-3 si aggira tra 1:1 o 2:1, ma si è visto che anche un rapporto di 4:1 può avere un effetto positivo sui pazienti asmatici (Simopoulos, 2003) e sulla diminuzione della mortalità in pazienti con un pregresso infarto del miocardio (Simopoulos, 2010). Il rapporto n-6:n-3 nel latte bovino descrive essenzialmente le concentrazioni di acido linoleico (LA) versus le concentrazioni dell’acido α-linolenico (ALA), in quanto rappresentano gli acidi grassi n-6 e n-3 più abbondanti. Il foraggio è ricco di ALA, mentre i cereali (come l’orzo, il mais, l’avena ed anche la soia) contengono maggiori quantità di LA (Khiaosa-Ard et al., 2010). Un rapporto n-6:n-3 più basso è quindi indicativo di una dieta a base di foraggio. Le concentrazioni dei singoli AG nel grasso del latte sono influenzate dalla razza bovina (Croissant et al., 2007), dallo stadio di lattazione (Craninx et al., 2008; Nantapo et al., 2014), dalla genetica (Soyeurt et al., 2008) e dalla dieta. La dieta è di particolare importanza quando si confrontano i sistemi di allevamento che forniscono un’alimentazione a base di concentrati con quelli basati sul pascolo. La composizione degli AG del latte negli allevamenti basati sul pascolo è inoltre soggetta a variazioni stagionali che influenzano la quantità e la qualità dei foraggi disponibili. Le specifiche caratteristiche delle diete a base di foraggio sono state ampiamente studiate. Adler et al. (2013), ad esempio, hanno messo a confronto la gestione del pascolo a lungo termine con quello a breve termine. La composizione dei pascoli negli allevamenti biologici a lungo termine evidenziava una percentuale minore di leguminose (Fabacee) ed una percentuale maggiore di altre famiglie di dicotiledoni rispetto agli allevamenti biologici a breve termine. Differenze nella composizione degli AG del latte proveniente dai 2 sistemi biologici sono state riscontrate da C9:0 a C12:0 e tali differenze sono state spiegate con la variabilità della composizione dei pascoli. Analogamente, Baars et al. (2012) hanno osservato differenze significative a partire da C4:0 fino a C11:0 in campioni di latte raccolto da bovine alimentate con fieno di pascolo o fieno di orzo. Ciò descrive come piccole differenze nella dieta possano influenzare la composizione degli acidi grassi del latte. Diversi ricercatori hanno documentato anche le differenze che esistono, per quanto riguarda il profilo degli AG del latte, nelle diverse razze di bovini. Maurice-Van Eijndhoven et al. (2011) hanno messo a confronto 4 razze bovine (Frisona Olandese, Mosa-Reno-Yssel, Groningen WhiteHeaded e Jersey) nei Paesi Bassi ed hanno riscontrato differenze significative nella percentuale totale di grasso, così come nella concentrazione di AG a catena corta e media (SMCFA), di acido vaccenico (VA) e di CLA (C18:2 cis-9,trans-11). Differenze simili tra le razze (per quanto riguarda la concentrazione e la composizione dei grassi nel latte) sono state osservate anche da Ramalho et al. (2012) e da Carroll et al. (2006). Soyeurt et al. (2007) hanno analizzato i dati di 7.700 campioni di latte, provenienti da 25 mandrie, rappresentative di 7 razze bovine tra cui Frisona Olandese e Jersey. Hanno osservato che l’ereditarietà relativa alla produzione di latte, alle proteine del latte e alla percentuale di grasso era, rispettivamente, 18, 28 e 32%. Inoltre, il 20% della variabilità nella composizione dei grassi del latte, in particolare per quanto riguarda l’AG più abbondante in esso, era dovuta alla genetica. La tabella 3 riporta una sintesi degli studi che mettono a confronto la composizione degli acidi grassi del latte nelle diverse razze. Per la maggior parte degli allevamenti da latte convenzionali, l’effetto della razza sulla composizione del latte potrebbe essere considerato trascurabile, poiché la razza Frisona è quella predominante in tali sistemi di produzione; tuttavia, il ceppo e il merito genetico possono influenzare in altro modo la composizione e le prestazioni del latte nell’ambito di specifici sistemi di allevamento (Auldist et al., 2000; Nauta et al., 2009). I produttori di latte biologico preferiscono razze diverse dalla Frisona e gli incroci, quindi in questo caso le generalizzazioni sono meno appropriate (Nauta et al., 2006; Honorato et al., 2014). I singoli AG contenuti nel latte vaccino provengono da fonti diverse (ad esempio, dieta, rumine e mammella). Una maggior comprensione dell’origine degli AG potrebbe aiutare a spiegare la variabilità osservata nei diversi campioni di latte. Anche i SFA a catena pari, con lunghezza da C4 fino a C16 sono prodotti ex-novo nella mammella a partire dagli acidi acetico e butirrico (Lindmark Månsson, 2008). Gli AG a catena dispari ramificati (OBCFA) vengono sintetizzati dai batteri ruminali ed indirettamente condizionati dalla dieta, mentre gli acidi grassi a lunga catena (compreso C16:0) e i PUFA originano direttamente dagli alimenti. Una buona percentuale dei PUFA viene bio-idrogenata nel rumine, con fino al 99% di ALA che è parzialmente o completamente idrogenato (Leiber et al., 2005). Dall’altra parte, una buona percentuale di AG viene desaturata a livello della mammella per mezzo della Δ9-desaturasi (Vlaeminck et al., 2006). I PUFA a lunga catena acido eicosapentaenoico (EPA) e acido docosaesaenoico (DHA) vengono convertiti a livello endogeno partendo dall’ALA nella ghiandola mammaria, ma il tasso di conversione è basso (Tu et al., 2010). Piccole quantità di acidi grassi del latte possono derivare dal tessuto adiposo dell’animale. Ciò si verifica principalmente quando l’animale è in bilancio energetico negativo e si osserva come un aumento della concentrazione di acido oleico (C18:1 cis-9) nel latte (Gross et al., 2011; Loften et al., 2014).
Contenuto di proteine del latte
La concentrazione e la composizione proteica del latte sono in larga parte poco sensibili ai cambiamenti dell’alimentazione e del management (Walker et al., 2004). Invece la concentrazione proteica del latte viene significativamente influenzate dalla genetica del singolo soggetto, dallo stadio di lattazione e dalla razza (Maurice- Van Eijndhoven et al., 2011). Bilik e Lopuszanska-Rusek (2010), Kuczyska et al. (2012), così come gli studi condotti da Hanus et al. (2008b) e Sundberg et al. (2010), hanno evidenziato un maggior quantitativo di proteine nel latte convenzionale. Müller e Sauerwein (2010) hanno segnalato che il latte convenzionale aveva la tendenza a contenere una maggiore concentrazione proteica. Vicini et al. (2008) hanno invece riportato un significativo aumento della concentrazione proteica nel latte biologico, rispetto al latte convenzionale e al latte ricombinante bST-free (3.22 vs. 3.14 vs. 3.15% di proteine, rispettivamente). Analogamente, Anacker (2007) ha osservato concentrazioni proteiche maggiori nel latte biologico raccolto mensilmente per un periodo della durata di 2 anni, in 2 allevamenti convenzionali e in un allevamento biologico (3.39 vs. 3.20% nel latte biologico e in quello convenzionale, rispettivamente; P < 0.001). La concentrazione di proteine nel latte è correlata positivamente con la ME e, in misura minore, con l’assunzione di MP. L’interazione tra l’amido della dieta e la CP influenza la produzione di latte e la concentrazione di proteine (Cabrita et al., 2007). Di conseguenza, l’integrazione della dieta con concentrati a base di amido può aumentare il tasso della sintesi proteica a livello della mammella (Rius et al., 2010). Le normative sull’allevamento biologico limitano l’utilizzo di integratori; pertanto, ci possiamo aspettare concentrazioni proteiche inferiori nel latte proveniente da aziende biologiche. Maggiori concentrazioni di proteine nel latte possiamo riscontrarle in mandrie costituite principalmente da capi di razza Frisona della Nuova Zelanda, rispetto a quelle costituite da vacche di razza Holstein statunitensi con una dieta simile (Auldist et al., 2000). Anche le diverse tipologie di foraggio o di cereali e il tasso di applicazione dei fertilizzanti possono influenzare la concentrazione di proteine del latte. Moorby et al. (2009) hanno osservato una diminuzione della concentrazione di proteine del latte quando è stato sostituito l’insilato di trifoglio rosso con l’insilato di loietto, mentre Vanhatalo et al. (2006) hanno riportato una riduzione della concentrazione di proteine del latte in seguito alla somministrazione di avena invece che di orzo. Un abbassamento delle concentrazioni di proteine nel latte si è verificato in seguito all’applicazione di quantità maggiori di azoto fertilizzante (240 kg di N/ha rispetto a niente, e 150 rispetto a 25 kg di N/ha) (Hermansen et al., 1994; Mackle et al., 1996). Di conseguenza, le differenze nell’intensificazione della coltivazione dei pascoli possono andare ad influire sulla concentrazione proteica del latte.
Contenuto di lattosio nel latte
Il lattosio, il principale carboidrato del latte, è deputato al mantenimento dell’osmolarità ed è positivamente correlato al volume del latte (Shahbazkia et al., 2010). I meccanismi e la biologia della sintesi e della regolazione del lattosio sono oggetto di studi tutt’ora in corso (Jenkins e McGuire, 2006). Le concentrazioni delle 2 proteine che compongono l’enzima lattosio sintasi, α-lattoalbumina e β1,4-galattosiltransferasi, sono correlate positivamente alle concentrazioni di proteine, di grassi e di lattosio contenute nel latte, e allo stadio di lattazione (Bleck et al., 2009). L’interazione tra l’amido della dieta e la CP può influire sulla concentrazione e sulla produzione di lattosio (Rius et al.., 2010). Tuttavia, i cambiamenti nella concentrazione di lattosio causati da modificazioni dell’alimentazione sono meno comuni e si verificano solo in circostanze estreme (Jenkins e McGuire, 2006). Studi sul latte umano non hanno mostrato l’esistenza di alcuna correlazione tra concentrazione di lattosio e alimentazione materna (Lönnerdal et al., 1976; Emmett e Rogers, 1997). Lemosquet et al. (2009) non hanno riscontrato alcun legame tra il tasso di glucosio corporeo e la resa di lattosio nel latte di bovine precedentemente sottoposte ad infusione duodenale di glucosio. Analogamente, il livello di MP nella dieta non ha effetti sulla percentuale di lattosio contenuto nel latte (Wang et al., 2007). Lo stadio di lattazione (Walker et al., 2004) e la SCC (Forsbäck et al., 2010) influenzavano il contenuto di lattosio, mentre non è stata rilevata alcuna differenza di concentrazione di questo zucchero tra le razze bovine Frisona, Jersey, Bruna Svizzera e Ayrshire (Bleck et al., 2009). Diverse pubblicazioni non hanno riportato l’esistenza di differenze significative nel contenuto di lattosio tra il latte biologico e quello prodotto in maniera convenzionale (Roesch et al., 2005; Nauta et al., 2006; Bilik e Lopuszanska-Rusek, 2010); tuttavia, Kuczyska et al. (2012) hanno osservato differenze nella concentrazione di lattosio tra le due tipologie di latte dopo che le bovine sono passate ad una dieta al chiuso. Non sono state individuate però le motivazioni di tale cambiamento. Zagorska e Ciprovica (2008) hanno evidenziato dei cambiamenti nella concentrazione di lattosio tra i diversi sistemi di allevamento ed hanno ipotizzato che la differenza tra le diete potrebbe essere la possibile causa.
Riassunto delle principali componenti
I risultati riportati relativi alla produzione di latte e alle concentrazioni di grassi, proteine e lattosio sono inconcludenti se considerati esclusivamente dal punto di vista della tipologia di allevamento (biologico versus convenzionale). Possiamo aspettarci risultati apparentemente contraddittori (come elencato nella Tabella 5) quando i singoli risultati delle prove non vengono contestualizzati. I fattori che influenzano le concentrazioni di grassi e di proteine nel latte devono essere tenuti in considerazione prima di trarre conclusioni sul fatto che il latte biologico e quello convenzionale abbiano una composizione chimica diversa. Le prove individuali devono riportare informazioni basilari circa la razza delle bovine e la dieta, insieme a tutti gli altri fattori che potrebbero essere responsabili dei risultati ottenuti (ad esempio, età, SCC, stadio di lattazione e impiego di fertilizzante). Sfortunatamente, molti autori nei loro studi non forniscono alcuna indicazione sulla dieta o sulla razza impiegate anche se, notoriamente, entrambi questi fattori sono in grado di influenzare la composizione del latte (Toledo et al., 2002). Sundberg et al. (2010) hanno dimostrato che le interazioni tra il sistema di allevamento e la razza apparivano significative ed hanno influenzato tutti i tratti della produzione di latte, compresi i grassi del latte e la resa proteica. Cabrita et al. (2007) hanno osservato interazioni significative tra amido della dieta e CP in grado di influenzare la produzione di latte, il contenuto e le concentrazioni di proteine e di lattosio. È quindi piuttosto difficile giungere ad una conclusione sulle differenze esistenti tra il latte biologico e quello convenzionale relativamente alle principali componenti del latte se questi ultimi fattori sono sconosciuti.
Tabella 5. Differenze nella composizione del latte tra produzione biologica e convenzionale
1 Latte venduto al dettaglio.
2 Dati provenienti da 188 allevamenti biologici e da 152 allevamenti convenzionali nei Paesi Bassi, raccolti tra il 1990 e il 2004.
3 Durante la stagione di pascolo tardiva.
4 Dati provenienti da 35 allevamenti biologici e da 33 allevamenti convenzionali situati nel Nord Reno-Westfalia nell’ovest della Germania, raccolti tra il 2002 e il 2004.
5 Durante l’inizio della stagione al chiuso.
Latte Convenzionale Versus Latte Biologico: acidi grassi
Latte proveniente dalla vendita al dettaglio e dai caseifici
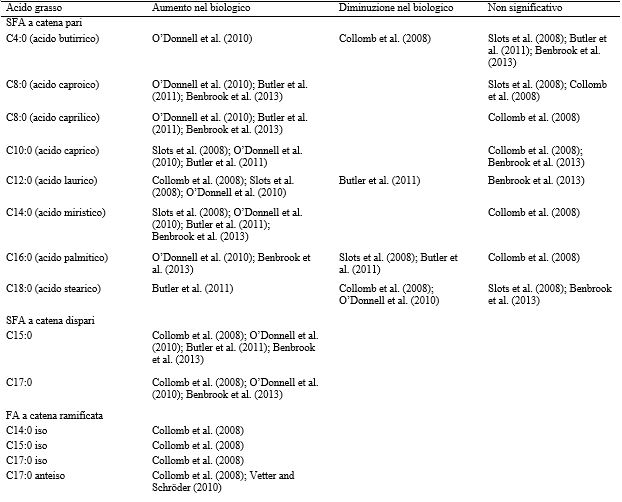
Gli acidi grassi sono i componenti maggiormente studiati quando si effettua un confronto tra latte biologico e latte convenzionale, con buona parte degli studi che si concentrano sulla composizione degli AG. In questa review, gli studi che analizzavano campioni di latte provenienti da punti vendita al dettaglio e da caseifici sono stati considerati separatamente da quelli che raccoglievano campioni nei singoli allevamenti o dai singoli animali. I campioni provenienti dalla vendita al dettaglio sono costituiti da una miscela di vari tipi di latte proveniente da un’ampia varietà di singole vacche e di allevamenti. Di conseguenza ciò “diluisce” l’effetto di ogni singola vacca e di specifiche pratiche allevatoriali (Tabella 6). Gli estremi sono, quindi, meno significativi (ad esempio, genetica, salute, gemellarità e stadio di lattazione delle singole vacche; aspetti specifici dell’azienda per quanto concerne la dieta, la razza, il drenching e l’applicazione dei fertilizzanti). Tuttavia, le norme (ad esempio, gli standard alimentari e i finanziamenti), le caratteristiche geografiche (ad esempio, il clima e l’altitudine) e le caratteristiche regionali (ad esempio, le razze locali impiegate e le pratiche di allevamento) possono influenzare la composizione degli acidi grassi del latte indipendente dal singolo allevamento e dagli effetti della dieta e della razza bovina adottate in una regione specifica. Tra novembre 2008 e ottobre 2009, Kliem et al. (2013) hanno analizzato dei campioni di latte convenzionale acquistati mensilmente presso 5 punti vendita situati in un raggio di 8 km nel Regno Unito. Tra i vari supermercati sono state osservate differenze significative per quanto riguardava il profilo degli AG e ciò è stato spiegato con l’esistenza di diversi pool di fornitori di latte, probabilmente provenienti da aree geografiche differenti (Kliem et al., 2013). Non a caso, il confronto dei diversi studi su latte biologico e convenzionale venduto al dettaglio, come indicato in tabella 6, ha mostrato risultati discordanti per la maggior parte dei SFA a catena pari. Pertanto, non è possibile trarre alcuna conclusione sul fatto che uno specifico AG aumenti o diminuisca nelle due tipologie di latte (biologico o convenzionale). I risultati sui OBCFA sono più concordanti, ma il numero di studi che li prende in considerazione è limitato. I risultati relativi ai MUFA e ai PUFA sono maggiormente omogenei e concentrazioni più elevate nel latte biologico di VA, CLA, ALA e EPA sono state riportate indipendentemente dal paese di origine (Stati Uniti, Regno Unito, Danimarca, Germania, Svizzera e Italia), dalla stagione di campionamento (da gennaio a dicembre) e dall’anno (dal 2003 al 2011). Questo risultato potrebbe suggerire che, indipendentemente dalla provenienza, le vacche allevate con metodo biologico consumano una dieta diversa (maggiore quantità di pascolo e di altri foraggi) rispetto alle vacche presenti in allevamenti convenzionali.
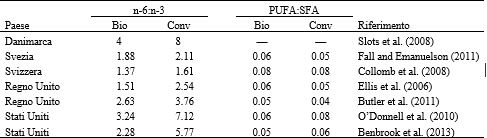
Tabella 6. Rapporto tra gli acidi grassi n-6 e n-3 e PUFA:SFA nel latte biologico (Bio) e convenzionale (Conv) venduto al dettaglio e proveniente da paesi differenti
Questo può essere il risultato diretto delle normative che impongono che le vacche da latte biologiche allevate negli Stati Uniti e nei paesi Europei (Department for Environment, Food and Rural Affairs, 2010) abbiano accesso al pascolo e a paddock esterni. Alcuni studi suggeriscono che gli acidi grassi omega-3 e i CLA siano benefici per la salute del consumatore (Givens, 2005; Nagpal et al., 2007). Si potrebbe quindi concludere che il latte biologico venduto al dettaglio sarebbe vantaggioso per il consumo umano. Tuttavia, il paragone tra i quantitativi effettivi dei singoli FA (Tabella 7) e il rapporto tra gli AG n-6:n-3 (Tabella 8) ha mostrato un’enorme variabilità tra i paesi e sostiene l’affermazione di Schönfeldt et al. (2012) secondo la quale i dati sul latte sono specifici per paese. Se confrontate, le percentuali di PUFA e di SFA sono simili, solamente Collomb et al. (2008) hanno riportato valori significativamente più elevati rispetto agli altri studi. Ciò può essere spiegato da condizioni specifiche dello studio condotto nell’area montuosa della Svizzera, dove l’alimentazione (sia delle bovine biologiche sia di quelle convenzionali) è basata su elevati quantitativi di foraggio. Kuczynska et al. (2011) hanno riportato rapporti PUFA:SFA analogamente elevati per le bovine che seguivano una dieta ad elevato contenuto di foraggio durante la stagione estiva. Le cause delle diverse tendenze tra gli studi sui singoli acidi grassi (ad esempio, i SFA) sono variabili, ma vengono ampiamente influenzate dalle caratteristiche nazionali e regionali. In uno studio condotto negli Stati Uniti tra l’ottobre e il novembre 2006, O’Donnell et al. (2010) hanno riscontrato nel latte biologico al dettaglio contenuti più elevati per tutti i SFA, ad eccezione di C18:0. Sempre negli Stati Uniti, Benbrook et al. (2013) hanno studiato la composizione degli AG nel latte venduto al dettaglio eseguendo raccolte mensili, da gennaio 2011 a luglio 2012. I risultati per tutti gli AG corrispondevano a quelli ottenuti da O’Donnell et al. (2010), ma non sono state osservate differenze significative tra le tipologie di latte per quanto riguardava C4:0, C10:0 e C18:0. Lo studio di O’Donnell et al. (2010) è stato condotto prima dell’entrata in vigore, nel 2010, degli standard USDA per il biologico, in base ai quali le vacche allevate con metodo biologico devono avere un accesso al pascolo di 120 d/anno e devono assumere il 30% del loro DMI dal pascolamento. Il cambiamento nei valori degli AG del latte tra i due studi americani (O’Donnell et al., 2010; Benbrook et al, 2013) potrebbe essere dovuto alle modificazioni degli standard, ma è necessario considerare anche la significativa differenza nella lunghezza dello studio. Butler et al. (2011) hanno riportato che campioni raccolti in Inghilterra, tra agosto 2006 e gennaio 2008, evidenziavano che il latte biologico conteneva quantitativi inferiori di C12:0 e C16:0, ma non vi era alcuna differenza significativa tra le due tipologie di latte per quanto riguardava C4:0. L’UK register of Organic Food Standards (UKROFS) afferma che gli erbivori dovrebbero avere un DMI costituito da almeno il 60% di foraggio, fresco o essiccato, o insilato. Questa differenza di standard potrebbe spiegare la differenza esistente nella composizione degli acidi grassi tra il latte biologico e quello convenzionale prodotto negli Stati Uniti e nel Regno Unito. Il latte di massa biologico e convenzionale raccolto da 3 allevamenti in Svizzera non mostrava differenze significative per quanto riguardava i SMCFA, ad eccezione del C12:0, che era più elevato nel latte biologico, e del C4:0, che invece era più elevato nel latte convenzionale (Collomb et al., 2008). Slots et al. (2008) hanno prelevato campioni di latte proveniente da caseifici danesi ed hanno osservato che i SMCFA erano o maggiori nel latte biologico o non significativamente diversi tra le due tipologie di latte, ad eccezione del C16:0. Collomb et al. (2008) hanno riferito che, sebbene la dieta delle bovine biologiche non fosse identica a quella delle bovine convenzionali, in entrambi i gruppi più dell’80% del loro DMI proveniva dall’erba (erba fresca, insilato di erba o fieno), il che potrebbe spiegare perché non sono state riscontrate differenze per la maggior parte dei SMCFA. Questa dieta differiva significativamente dagli standard applicati negli Stati Uniti e nel Regno Unito. Negli studi sopra menzionati, a parte le differenze nella tipologia, nella quantità e nella qualità del foraggio, anche le diversità delle razze o dei ceppi allevati potrebbero essere potenziali fattori che contribuiscono alle differenze riportate circa il profilo degli acidi grassi del latte tra i campioni di latte biologico e convenzionale e all’interno degli stessi campioni. È impossibile determinare l’effetto reale della razza negli studi presentati, ma non si può certo escluderlo. Collomb et al. (2008) hanno riferito che le razze Bruna Svizzera, Swiss Fleckvieh, Simmental e Frisona rossa erano le razze predominanti nello studio svizzero, mentre lo studio di Butler et al. (2011) nel Regno Unito escludeva il latte proveniente da razze minoritarie. La razza non è stata menzionata da Slots et al. (2008) o da O’Donnell et al. (2010). Pertanto, possiamo solo presumere che le circostanze in cui questi studi sono stati condotti riflettano le condizioni previste da questi paesi. La Frisona è la razza più allevata nel Regno Unito, negli Stati Uniti e in Danimarca, dove rappresenta, rispettivamente il 95, il 90 e il 72% della totalità delle bovine da latte (Nygaard, 2007; Department for Environment, Food and Rural Affairs, 2010), ma negli allevamenti biologici c’è la tendenza a preferire razze diverse dalla Frisona (Roderick e Burke, 2004; Sundberg et al., 2010; Benbrook et al., 2013). Si ipotizza che la percentuale di vacche Frisone nella mandria da latte possa variare da paese a paese, così come all’interno della popolazione di vacche allevate con metodo biologico e convenzionale; di conseguenza, questo andrà ad influenzare la composizione degli acidi grassi presenti nel latte.
Tabella 7. Composizione degli acidi grassi del latte biologico e convenzionale venduto al dettaglio
Latte proveniente dai gruppi di ricerca e dagli allevamenti da latte
Gli studi che ricercano la differenza tra campioni di latte biologico e convenzionale provenienti da un numero limitato di animali e di allevamenti da latte possiedono limitate capacità per concludere se le due tipologie di latte differiscano. A seconda del numero di aziende e di animali coinvolti, questi studi devono tenere conto di più fattori (ad esempio, genetica animale, gestione del singolo capo, caratteristiche specifiche della mandria e microclima), per evitare di trarre conclusioni basate sulla variabilità della mandria o dell’animale (Hou, 2011) piuttosto che sul sistema di allevamento (organico o convenzionale). Il vantaggio di questi studi sta nella loro capacità di misurare e controllare i fattori influenti e, di conseguenza, di caratterizzarne gli effetti. Adler et al. (2013), ad esempio, hanno confrontato campioni di latte provenienti da 28 aziende biologiche e convenzionali e sono stati in grado di spiegare le differenze esistenti tra le due varietà di latte in termini di composizione del pascolo, profilo degli AG nel concentrato e variabilità stagionali. Differenze nel profilo degli acidi grassi tra latte biologico e convenzionale sono state riscontrate (tra gli altri) per C18:0, C18:1 cis-9, ALA, EPA, e DHA. Le concentrazioni di C18:0 e C18:1 cis-9 erano maggiori nel mangime concentrato utilizzato per le vacche convenzionali, cosa che si rifletteva nella composizione del latte convenzionale. Lo stesso è stato osservato per l’ALA, maggiormente presente nei concentrati per bovini biologici e, quindi, anche nel latte ottenuto da essi. Quantità maggiori di EPA e DHA nel latte biologico possono essere spiegate dall’utilizzo di olio di pesce nelle diete di vacche biologiche. Altri studi sono inconcludenti quando si tratta di riportare le (possibili) cause dei loro risultati. Butler et al. (2008) hanno studiato 25 allevamenti commerciali durante il periodo di pascolo e li hanno classificati come allevamenti convenzionali ad alto input (HI), allevamenti biologici a basso input (LI) e allevamenti convenzionali LI. Gli allevamenti biologici e convenzionali a basso input non hanno mostrato differenze significative per quanto concerne VA, ALA, SFA totali, MUFA, PUFA o rapporto n-6:n-3. Negli allevamenti convenzionali HI, il contenuto di SFA totali risultava aumentato, mentre il contenuto totale di MUFA, PUFA, VA, ALA e CLA nel latte si era ridotto rispetto a quello degli allevamenti LI. Questa differenza nelle concentrazioni è risultata ancora più marcata per gli allevamenti convenzionali LI piuttosto che per gli allevamenti biologici LI. Le differenze tra le aziende HI e LI per quanto concerne il profilo degli AG del latte e la somiglianza tra i due sistemi LI possono essere spiegate dalla dieta utilizzata, poiché entrambi i sistemi LI prevedevano una dieta con più dell’80% di foraggio fresco, rispetto ai sistemi di allevamento HI che ne prevedevano meno del 40%. In Butler et al. (2008), alle bovine biologiche LI veniva somministrata buona parte della loro dieta come foraggi conservati e concentrati rispetto alle bovine convenzionali LI, cosa che potrebbe spiegare la concentrazione significativamente più alta di CLA nel latte di allevamenti convenzionali LI. Una possibile causa della maggiore percentuale di foraggio fresco nella dieta convenzionale LI potrebbe essere correlata all’applicazione di fosfato e di fertilizzante azotato nell’allevamento convenzionale LI, che potrebbe aver portato ad una maggiore resa in DM a parità di stessa area delle aziende biologiche LI. Anacker (2007) ha studiato 1 azienda biologica e 2 aziende convenzionali mensilmente per anni consecutivi ed ha riscontrato quantità più elevate di C18:0, LA, CLA, ALA e acidi grassi n-3 nel latte biologico, mentre per C18:1 cis-9 o per i SFA non ha osservato alcuna differenza significativa tra latte biologico e convenzionale. Non sono state fornite specifiche sulla dieta per spiegare questi risultati, ma la dieta delle vacche biologiche era costituita da foraggio verde e da un massimo del 40% di concentrato. Inoltre, non venivano impiegati fertilizzanti chimici o pesticidi nell’azienda biologica. Un maggior quantitativo di ALA e di PUFA nel latte biologico potrebbero essere spiegato dal fatto che presumibilmente le bovine allevate con metodo biologico ricevono un maggiore apporto di foraggio rispetto a quelle convenzionali. Valori più elevati di acidi grassi n-3 e CLA (P = 0.067) in campioni di latte biologico di massa sono stati riscontrati anche da Bloksma et al. (2008) nelle bovine biologiche che avevano pascolato maggiormente e con un elevato apporto di insilato di trifoglio, mentre le bovine convenzionali avevano consumato più concentrato ed insilato di mais. Jahreis et al. (1997) hanno osservato quantità significativamente maggiori di CLA nel latte proveniente da aziende biologiche e convenzionali con accesso al pascolo in estate e con una dieta ricca di insilati in inverno, rispetto alle quantità presenti nel latte di vacche convenzionali alimentate con più concentrati ed insilati di mais. Questo viene spiegato dalla maggior quantità di PUFA nei pascoli freschi, che comporta un aumento di VA e CLA. Una quantità maggiore di CLA nel latte di vacche biologiche, rispetto a quello di vacche convenzionali alimentate con foraggio (compreso il pascolo), può essere attribuita alla diversità degli insilati utilizzati nel periodo invernale. Le vacche allevate con metodiche biologiche hanno consumato insilati d’erba e di trifoglio, molto più ricchi di PUFA rispetto agli insilati di mais. È stato inoltre ipotizzato che i pascoli e gli insilati biologici contenendo un maggior quantitativo di fibra grezza, potrebbero aver influenzato la composizione del microbiota ruminale (Jahreis et al., 1997).
Tabella 8. Concentrazione di acidi grassi selezionati nel latte biologico (Bio) e convenzionale (Conv) venduto al dettaglio nei diversi paesi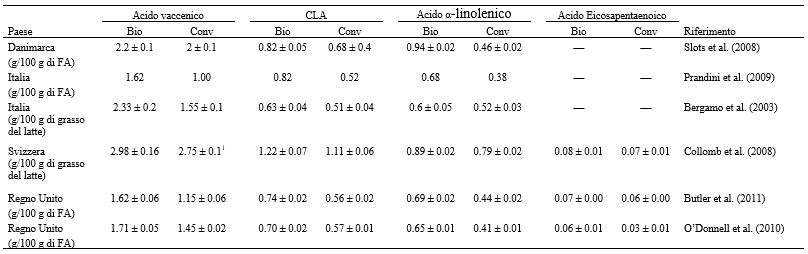
Ellis et al. (2006) non hanno osservato differenze significative tra le 2 tipologie di latte per quanto riguarda il CLA complessivo. Ciò può essere spiegato con l’aumento della numerosità del campione (36 allevamenti coinvolti), che ha portato ad una variabilità più ampia delle concentrazioni di CLA all’interno dei sistemi di allevamento rispetto ad altri studi, con i singoli fattori legati all’allevamento che potrebbero aver influenzato significativamente la concentrazione di CLA. Analogamente Molkentin e Giesemann (2007) hanno riportato un marcato cambiamento nella concentrazione di ALA nel latte biologico, causato dall’ampia varietà di mangimi impiegati, se paragonata a quella degli allevamenti convenzionali. L’utilizzo del pascolo ha portato ad un significativo incremento della concentrazione di CLA nel latte, rispetto all’alimentazione a base di insilato e TMR. Ellis et al. (2006) hanno inoltre dimostrato che l’alimentazione al pascolo, la preferenza di mandrie costituite da incroci di razze e la scelta di mandrie con rese di latte inferiori sono fattori che hanno aumentato significativamente le concentrazioni di acidi grassi n-3 nel latte. Di conseguenza devono essere considerati tutti i molteplici fattori, ed anche le interazioni tra di essi, prima di riuscire a valutare la reale esistenza di differenze tra latte biologico e latte convenzionale.
Latte Convenzionale Versus Latte Biologico: componenti minori
Vitamine e antiossidanti
Il latte contiene acqua e vitamine liposolubili, e diversi studi di ricerca hanno esaminato se le concentrazioni di questi nutrienti essenziali differissero tra il latte biologico e quello convenzionale. Numerosi studi si sono concentrati sulla vitamina A, sul suo precursore β-carotene, e sull’α-tocoferolo, una forma della vitamina E. Essendo degli antiossidanti, sono molecole molto interessanti per i soggetti che si occupano della trasformazione del latte perché possono prevenire la comparsa spontanea del sapore ossidato del latte. Una maggiore quantità di PUFA, (comunemente rilevabile nel latte biologico) e il conseguente aumento del rischio di incorrere nell’ossidazione, fa si che sia auspicabile avere un maggior quantitativo di antiossidanti nel latte biologico. Il contenuto di α-tocoferolo e β-carotene nel latte dipende dal contenuto della dieta (Swensson e Lindmark-Mansson, 2007; Mogensen et al., 2012). La concentrazione più alta di vitamine (α-tocoferolo e β-carotene) si ritrova nel foraggio fresco. La perdita di vitamine che si verifica durante l’appassimento, l’insilamento e lo stoccaggio può interessare, in maniera differente, le diverse colture (ad esempio, segale, trifoglio e mais) (Kala, 2011; Blank et al., 2013). I foraggi e i cereali conservati o essiccati vengono considerati una fonte più povera di α-tocoferolo e β-carotene rispetto al foraggio fresco (Kay et al., 2005). Tuttavia, i risultati sul fatto che il latte ottenuto da animali sottoposti ad una dieta ricca di foraggi freschi (comunemente biologici) contenga più β-carotene e α-tocoferolo, rispetto al latte di animali che consumano maggiori quantità di concentrati (comunemente convenzionali) sono discordanti, poiché i concentrati possono essere integrati con vitamine. Butler et al. (2008) hanno riportato quantità maggiori di α-tocoferolo e β-carotene in campioni di latte di massa provenienti da allevamenti biologici e convenzionali LI, piuttosto che nel latte proveniente da allevamenti convenzionali HI. Concentrazioni maggiori di α-tocoferolo e β-carotene nel latte biologico sono state riportate anche da Bergamo et al. (2003) e Slots et al. (2008). Slots et al. (2008) hanno osservato che la differenza totale nella concentrazione di α-tocoferolo tra le due tipologie di latte era meno significativa (P < 0.023) rispetto a quella dei singoli stereoisomeri. Lo stereoisomero naturale RRR α-tocoferolo era significativamente più alto nel latte biologico, mentre lo stereoisomero sintetico 2R dell’ α-tocoferolo era significativamente più alto nel latte convenzionale (P < 0.001). Risultati simili sono stati descritti da Butler et al. (2008) che hanno riportato quantità significativamente più elevate di RRR α-tocoferolo nel latte biologico LI e in quello convenzionale LI rispetto al latte convenzionale HI, senza alcuna differenza significativa per quanto riguardava il contenuto dello stereoisomero sintetico 2R tra le 3 varietà di latte. Lo studio ci indica che gli antiossidanti sintetici possono essere presenti nel latte biologico e che il latte convenzionale può avere simili concentrazioni elevate di α-tocoferolo, legate all’integrazione nei concentrati. Sono state riportate differenze significative anche per la quantità di carotenoidi (incluso il β-carotene), con le concentrazioni più alte e quelle più basse osservate, rispettivamente, nel latte convenzionale LI e in quello HI. La differenza nella concentrazione di antiossidanti tra il latte biologico LI e il latte convenzionale LI potrebbe essere correlata alla differenza nell’assunzione di foraggio fresco (Butler et al., 2008). Ellis et al. (2007b) non hanno riscontrato alcuna differenza significativa tra i livelli di α-tocoferolo e β-carotene nel latte biologico e nel latte convenzionale, mentre la vitamina A è risultata più elevata nel latte convenzionale. Hanno osservato che l’alimentazione a base di concentrato era correlata positivamente alle concentrazioni di vitamina A, α-tocoferolo e β-carotene nel latte, in aggiunta di ulteriori fattori influenti appartenenti ai singoli allevamenti, come il mese del campionamento e la resa di latte. Analogamente, Fall and Emanuelson (2011) non hanno individuato alcuna differenza significativa tra latte biologico e convenzionale per quanto riguardava il contenuto di β-carotene e di α-tocoferolo, durante il loro studio che metteva a confronto le mandrie di bovini da latte biologiche con quelle da latte convenzionali durante il periodo invernale. Come spiegazione a questi risultati è stata data l’assenza del pascolo fresco per le bovine biologiche e, quindi, la somiglianza dell’alimentazione tra le mandrie. Zagorska e Ciprovica (2008) si sono focalizzati sulla concentrazione nel latte delle vitamine idrosolubili tiamina e riboflavina (B1 e B2). Sono stati prelevati campioni da 5 allevamenti biologici e convenzionali in Lettonia, dai quali è risultato che le concentrazioni di entrambe le vitamine erano significativamente più basse (P < 0.05) nei campioni di latte biologico. Entrambe queste vitamine si ritrovano nei cereali (Powers, 2003; Gołda et al., 2004), ed un aumento della loro quantità nel latte convenzionale potrebbe essere dovuto ad un maggior apporto di cereali con la dieta somministrata tipicamente alle bovine convenzionali. Tutti gli studi dimostrano come la composizione dei mangimi, piuttosto che la tipologia di allevamento (biologico o convenzionale), influenzi la concentrazione delle vitamine (e dei loro precursori) nel latte.
Minerali
Diversi studi di ricerca hanno confrontato il contenuto minerale del latte biologico e di quello convenzionale. I singoli minerali devono essere considerati separatamente perché potrebbero essere benefici per gli animali e per gli esseri umani o potrebbero essere ritenuti dei contaminanti. Il contenuto di minerali nel latte è, a seconda dell’elemento, influenzato dalla genetica delle singole bovine (van Hulzen et al., 2009), dalla gestione dell’allevamento e dall’ambiente circostante (Gabryszuk et al., 2008). I fattori che influenzano la composizione minerale del suolo e dei pascoli includono l’applicazione di fertilizzanti (McKenzie e Jacobs, 2002), lo smaltimento dei fanghi di depurazione (Percival, 2003), la tipologia di suolo (Mut et al., 2009), la vicinanza alle aree minerarie (Smith et al., 2009), le attività industriali (Gabryszuk et al., 2008) o le emissioni automobilistiche (Ward et al., 1977).
Calcio e magnesio. Le concentrazioni di Ca e Mg nel latte sono strettamente ereditarie e solo marginalmente influenzate dalla dieta (van Hulzen et al., 2009). Il calcio nel latte è associato alla caseina, che rimane relativamente costante nel latte durante i cambiamenti di alimentazione dell’animale (Haug et al., 2007). Concentrazioni maggiori di Ca e Mg, così come di P, possono essere riscontrate in razze con concentrazioni più elevate di caseina e di fosfolipidi (ad esempio, Jersey vs. Frisona; Hermansen et al., 2005). Le concentrazioni di Ca e Mg aumentano con lo stadio di lattazione in seguito all’incremento della degradazione della αS-caseina dovuta alle variazioni del pH (Sapru et al., 1997; Coulon et al., 1998). Sebbene non discusso da Gabryszuk et al. (2008), lo stadio di lattazione potrebbe aver contribuito ad un aumento delle concentrazioni di Ca (P <0.01) e Mg (P <0.05) nel latte di vacche convenzionali HI (media di lattazione 162 giorni) e di vacche biologiche LI (media di lattazione 193 e 173 giorni), se paragonati al latte di vacche convenzionali LI (media di lattazione 117 giorni). Čuboň et al. (2008) hanno riportato livelli maggiori di Ca nel latte biologico di massa, ma non hanno riscontrato alcuna differenza nella concentrazione proteica totale tra latte biologico e latte convenzionale. I campioni di latte di questo studio provenivano da una mandria biologica e da una mandria convenzionale di dimensioni e razza simili (Slovak Pinzgauer), situate nella stessa area geografica, con il latte raccolto (al mattino e alla sera) e campionato per diversi mesi (da maggio a febbraio). Non è stata fornita alcuna spiegazione circa le differenze nella concentrazione di Ca, ma sono state riportate concentrazioni proteiche minime in mesi diversi : ad agosto, nel latte biologico e a maggio in quello convenzionale. Ciò potrebbe indicarci potenziali differenze nella concentrazione di caseina e nello stadio di lattazione tra i 2 allevamenti. Anche l’impiego di fertilizzanti, o di integratori a base di Na, potrebbe aumentare i livelli di Ca e di Mg nel latte bovino, diminuendo allo stesso tempo la SCC (Phillips et al., 2000).
Iodio e selenio. Il contenuto di I e Se nel latte biologico e convenzionale è stato ampiamente studiato, essendo entrambi questi elementi essenziali per la salute animale ed umana. La concentrazione di questi 2 elementi nel latte dipende in larga misura dalla dieta degli animali, infatti per evitare carenze nelle vacche da latte lo iodio è stato somministrato come integrazione per decenni (Bath et al., 2012). Lo iodio è facilmente assimilabile dalla dieta e viene immesso nel latte, e il latte prodotto da vacche alimentate con concentrati mostrava livelli di I maggiori rispetto al latte di vacche alimentate al pascolo (Gabryszuk et al., 2008). Nei paesi dove è prevista la stabulazione invernale, le concentrazioni di I nel latte sono largamente influenzate dalla stagione e dal successivo cambiamento della dieta, con livelli che diminuiscono in estate (Haug et al., 2007). Uno studio condotto sul latte venduto al dettaglio nel Regno Unito ha mostrato che, nonostante le variazioni regionali dei livelli di I, il latte convenzionale al dettaglio conteneva fino al 42% in più di iodio rispetto al latte biologico (Bath et al., 2012). Risultati simili provenivano da studi condotti in Germania (Johner et al., 2012), Norvegia (Dahl et al., 2003) e Spagna (Rey- Crespo et al., 2013). In tutti gli studi, la concentrazione di I era significativamente più bassa nel latte biologico, una differenza che appariva ancora più marcata durante la stagione estiva quando l’alimentazione al pascolo aumentava. Anche l’uso di disinfettanti iodofori per i capezzoli e per le attrezzature potrebbe influenzare l’aumento dei livelli di I nel latte e spiegare la variabilità delle concentrazioni di I osservate nel latte convenzionale (Bath et al., 2012; Rey-Crespo et al., 2013). Anche il selenio è un minerale essenziale e i ruminanti sono sensibili alla sua carenza dovuta ad un mancato assorbimento dalla dieta (van Hulzen et al., 2009). Questa situazione si verifica maggiormente negli animali alimentati con elevate quantità di pascolo piuttosto che in quelli che seguono una dieta a base di insilati o TMR (Gabryszuk et al., 2008). Pilarczyk et al. (2011) hanno riscontrato che nelle aree con bassi livelli di Se nel suolo, le vacche convenzionali alimentate con dieta a base di fieno, cereali e pascolo avevano livelli di Se nel latte significativamente più bassi rispetto alle vacche alimentate con TMR. Il contenuto di selenio nel latte di bovine biologiche che consumavano una dieta ricca di insilato d’erba e di mais era significativamente più elevato (P < 0.001) rispetto a quello di bovine convenzionali con accesso al pascolo (Pilarczyk et al., 2011). Fall and Emanuelson (2011) non sono stati in grado di stabilire l’esistenza di eventuali differenze nei livelli di Se nel latte di vacche biologiche e convenzionali in Svezia durante la stagione invernale, comunque, hanno citato la somiglianza tra le diete come spiegazione.
Metalli pesanti. Le concentrazioni di metalli pesanti nel latte bovino sono state un obiettivo di ricerca in molti paesi (Licata et al., 2004; Qin et al., 2009; Abdulkhaliq et al., 2012), principalmente a causa delle preoccupazioni relative ai loro effetti sulla salute umana. L’ambiente e l’alimentazione sono i 2 principali fattori che influenzano le concentrazioni di metalli nel latte, e le diverse razze di bovini possono risultare interessate in maniera differente (Hermansen et al., 2005). Anacker (2007) ha riferito che, sebbene non sia stata osservata alcuna differenza tra latte biologico e convenzionale, le concentrazioni di As, Cd, Cu e Hg cambiavano significativamente da un anno e all’altro. La principale fonte di metalli pesanti (come,ad esempio, As, Cd, Hg, e Pb) nei sistemi agricoli è il fertilizzante (Gray et al., 2003; Mirlean et al., 2008). Le differenze nell’applicazione dei fertilizzanti e nel tasso di crescita dei pascoli, potrebbero spiegare la variabilità delle concentrazioni dei metalli pesanti nei diversi anni riportata da Anacker (2007). Ghidini et al. (2005), mettendo a confronto il latte e la carne di produzione biologica con quella prodotta in modo convenzionale in Italia, in linea generale non hanno osservato alcuna differenza o hanno individuato concentrazioni molto basse di Cd e Pb. Risultati simili sulle concentrazioni di Cd, Cu, Fe, e Zn nel latte di massa biologico e convenzionale sono stati riportati da Zagorska e Ciprovica (2005), che hanno analizzato campioni provenienti da diverse regioni della Lettonia. Hanus et al. (2008a) hanno riportato elevati livelli di Cu nel latte convenzionale in uno studio comparativo che coinvolgeva allevamenti biologici e convenzionali della Repubblica Ceca. Analogamente, Rey Crespo et al. (2013) hanno osservato concentrazioni maggiori di Cu, Se e Zn nel latte convenzionale a livello di allevamento e di vendita al dettaglio rispetto al latte proveniente da allevamento biologico, e ciò è stato spiegato con l’elevato tasso di integrazione di questi elementi essenziali nei concentrati.
Ormoni
Il latte e i latticini contengono naturalmente estrogeni (Malekinejad et al., 2006) e i possibili effetti sulla salute umana interessano sicuramente la comunità scientifica (Daxenberger et al., 2001). Le concentrazioni di estrone (E1) e di estradiolo (αE2 e βE2) nel latte bovino sono positivamente correlate allo stadio di gestazione dell’animale. Le concentrazioni di estrogeni nel latte al dettaglio variano a seconda della percentuale del grasso del latte, visto il carattere lipofilo di questi ormoni (Pape-Zambito et al., 2010). Non è stata rilevata alcuna differenza significativa nella concentrazione di estrone tra il latte biologico e quello convenzionale. La concentrazione di estradiolo (βE2) nel latte biologico aumenta con una velocità maggiore all’aumentare del grasso rispetto a quanto succede nel latte convenzionale. Sebbene queste differenze siano significative, non sono state considerate biologicamente rilevanti. Una più alta percentuale di grassi nel latte biologico, rispetto a quella indicata sull’etichetta, potrebbe essere la causa della differenza riportata (Pape-Zambito et al., 2010). Vicini et al. (2008) hanno analizzato le concentrazioni di estradiolo e progesterone nel latte biologico e convenzionale venduto al dettaglio proveniente da 48 stati degli Stati Uniti, raccolto per un periodo di 3 settimane. Hanno riscontrato livelli maggiori di entrambi gli ormoni nel latte biologico (P < 0.05) ed hanno spiegato questa differenza con una minor assunzione di mangime da parte delle bovine allevate con metodiche biologiche e con le differenze nella media di gestazione tra le vacche biologiche e quelle convenzionali.
Latte Convenzionale Versus Latte Biologico: altri aspetti
Salute della mammella e SCC
Aspetti gestionali come l’igiene al momento della mungitura e la pulizia delle bovine (Ellis et al., 2007a) influenzano l’incidenza delle infezioni della mammella, che a loro volta possono influire sulla produzione e sulla composizione del latte. Le rese e le percentuali di proteine e grassi del latte possono essere correlate negativamente ad un’elevata SCC (Juozaitiene et al., 2004; Ogola et al., 2007; Guo et al., 2010). Di conseguenza le conclusioni sulle differenze di composizione tra il latte biologico e quello prodotto convenzionalmente, dovrebbero essere fatte dopo aver tenuto in considerazione anche la salute della mammella. La conta delle cellule somatiche (SCC) del latte biologico e di quello convenzionale è stata messa a confronto in una serie di studi pubblicati, la maggior parte dei quali non ha riportato differenze significative tra le 2 tipologie di latte (Muller e Lehmann, 2007; Müller e Sauerwein, 2010; Mullen et al., 2013; Stiglbauer et al., 2013). In Svezia, Sundberg et al. (2009) hanno studiato 471 allevamenti biologici e quasi 14.000 allevamenti convenzionali dal 1998 al 2005, e non hanno riscontrato differenze nella SCC a un dato livello di produzione. Altri hanno riportato una SCC più bassa nel latte biologico (Ellis et al., 2007a; Čuboň et al, 2008; Garmo et al., 2010). Roesch et al. (2007) hanno riscontrato una SCC media più elevata nel latte biologico a 31 giorni post-parto e una SCC simile per mandrie biologiche e convenzionali a 102 giorni post-parto. Analogamente, il numero dei casi di mastite subclinica e clinica non differivano tra vacche biologiche e convenzionali (Sundberg et al., 2009). Vaarst e Bennedsgaard (2001) hanno analizzato l’incidenza dei trattamenti per la mastite in 27 mandrie biologiche e in 57 mandrie convenzionali in Danimarca. Il sistema di allevamento (biologico vs. convenzionale) sembra avere una minore influenza sulla salute della mammella rispetto a fattori gestionali (ad esempio, il dipping sistematico dei capezzoli). Valle et al. (2007) hanno riportato che le differenze tra bovine biologiche e convenzionali nel trattamento sanitario (ad esempio, la richiesta di cure veterinarie), piuttosto che le differenze nello stato attuale di salute degli animali, potrebbero influenzare le statistiche sulle mastiti. Non sono state riscontrate differenze sulla salute degli animali tra le diverse tipologie di allevamento, ad eccezione di una minore incidenza di mastite clinica nelle aziende biologiche, che si ritiene sia in parte dovuta alla minor produzione di latte che si ha in questa tipologia di bovine (Valle et al., 2007). Richert et al. (2013) hanno osservato che l’intensità dell’allevamento piuttosto che il sistema (biologico vs. convenzionale) influiva sulla frequenza delle visite veterinarie. Ahlman et al. (2011), studiando 402 mandrie biologiche e 5.335 mandrie convenzionali tra il 1998 e il 2003, hanno riportato un tasso di abbattimento maggiore (a causa della cattiva salute della mammella) nelle vacche biologiche piuttosto che in quelle convenzionali. Ahlman et al. (2011) hanno osservato, analogamente a Valle et al. (2007), che i motivi dell’abbattimento potrebbero non dipendere solamente dallo stato di salute della mammella, ma anche dalle priorità e dai livelli di tolleranza dei singoli allevatori. Non è possibile generalizzare sul fatto che gli allevatori biologici abbiano o meno una tolleranza inferiore verso la cattiva salute della mammella, perché le considerazioni etiche possono essere diverse e le normative sull’utilizzo degli antibiotici (come opzione di trattamento per le vacche biologiche), differiscono da un paese all’altro (Mullen et al., 2013).
Aroma e gusto
Il latte biologico è associato non solo all’immagine di essere sicuro ed ecocompatibile, ma anche all’avere un sapore migliore rispetto al latte convenzionale (Managi et al., 2008; Liu et al., 2013). Sono state studiate le differenze di sapore nel latte proveniente da bovine alimentate con differenti quantitativi di concentrato e di pascolo (Croissant et al., 2007; Bloksma et al., 2008; Bovolenta et al., 2009), senza alcuna differenza di approvazione da parte dei consumatori. Analogamente, non è stata riscontrata alcuna differenza evidente di sapore quando confrontiamo il latte biologico con quello convenzionale, anche se alcune prove hanno dimostrato che il latte biologico è più cremoso ed ha un sapore erbaceo più intenso (Bloksma et al., 2008). La temperatura di consumo del latte (7 vs.15°C) influenza l’intensità di alcuni specifici aromi (Croissant et al., 2007), il che può essere spiegato dall’aumento della volatilità dei composti aromatici dopo l’applicazione di temperature più elevate. Cmen et al. (2010) hanno suggerito che una minore concentrazione di grassi nel latte biologico in primavera era correlata ad una perdita di sapore, mentre Coggins et al. (2008) hanno riferito che i panelist formati non sono stati in grado di distinguere tra yogurt semplici con diverso contenuto di grassi o tra la tipologie di latte (biologico vs. convenzionale). Gallina Toschi et al. (2012) analogamente hanno osservato che i consumatori non erano in grado di distinguere dall’odore e dal sapore dello yogurt se fosse prodotto con latte biologico o con latte convenzionale, ma hanno constatato che lo yogurt convenzionale più apprezzato otteneva un punteggio più alto quando veniva etichettato come biologico.
Identificazione
In seguito all’aumento dei prezzi premium per il latte biologico in un settore di vendita al dettaglio in crescita, i ricercatori hanno studiato quei fattori utili ad identificare o distinguere il latte biologico da quello convenzionale. Sono stati presi in considerazione diversi marcatori molecolari viste le loro concentrazioni significativamente differenti nel latte biologico e in quello convenzionale. La presunta differenza di concentrazione è dovuta alla diversificazione significativa della dieta che si ha tra vacche biologiche e convenzionali. Finora, tutti i marcatori proposti hanno fallito quando la dieta delle bovine allevate con metodiche biologiche e la dieta di quelle convenzionali erano simili (ad esempio, in allevamenti biologici LI e in allevamenti convenzionali LI). L’acido fitanico, ad esempio, che viene convertito dal fitolo rilasciato dalla clorofilla, può essere utilizzato come indicatore della quantità di foraggio verde presente nella dieta di una vacca da latte (Vetter e Schröder, 2010; Schröder et al., 2011). Pertanto, l’acido fitanico può essere impiegato per l’identificazione del latte biologico, con la limitazione che i confronti possono essere fatti solo con il latte di vacche convenzionali che hanno un accesso limitato al foraggio verde e con il latte di vacche biologiche alimentate principalmente con foraggio. Le stesse limitazioni sono state riscontrate per l’ALA impiegato come marcatore (Molkentin, 2009). Il latte biologico contiene generalmente maggiori quantità di ALA, apportate da maggiori quantità di foraggio fresco nella dieta, ma Flowers et al. (2008) hanno dimostrato come un’integrazione con il 5% di olio di lino fosse in grado di raddoppiare i livelli di ALA nel latte convenzionale, allineandosi così ai valori osservati nel latte biologico. Il metodo descritto da Molkentin (2008) determina il rapporto dell’isotopo stabile del carbonio (δ13C) nel latte. Il metodo si basa sul fatto che il mais (comunemente usato nei mangimi concentrati per vacche convenzionali) è una pianta C4 (rispetto ad altre comuni piante da foraggio), che utilizza un percorso biosintetico diverso per fissare la CO2 atmosferica. Questo porta ad un maggior accumulo dell’isotopo 13C nella pianta, che può essere riscontrato anche nel latte. Il metodo permetterebbe pertanto di determinare il quantitativo di mais presente nella dieta dell’animale. I limiti di questo metodo sono correlati alla necessità di fare una distinzione tra le diete biologiche e quelle convenzionali per quanto riguarda la concentrazione del mais e all’incapacità di stabilire se il mais somministrato è stato prodotto con metodiche biologiche o convenzionali. Boudonck et al. (2009) hanno effettuato una caratterizzazione del latte biologico e di quello convenzionale utilizzando la metabolomica. Ippurato, prolina, ribosio 5-fosfato e carnitina sono tra i 14 metaboliti identificati che differiscono significativamente tra le marche di latte intero biologico e convenzionale. È necessario stabilire se queste differenze siano causate o meno da differenze nella dieta o nei percorsi metabolici degli animali. L’acido ippurico viene considerato come un marcatore, ma si è visto che non è propriamente adatto, poiché il suo contenuto dipende dal regime alimentare piuttosto che dal sistema di produzione (Boudonck et al…, 2009; Carpio et al., 2010). Capuano et al. (2014) hanno esaminato la possibilità di distinguere tra i campioni di latte, appartenenti a bovine con o senza possibilità di accedere al pascolo, attraverso la spettroscopia infrarossa a trasformata di Fourier. Tuttavia, come anche in altri studi, la classificazione di un campione come biologico o convenzionale è stata effettuata con una certa cautela e non è stato possibile trarre delle conclusioni generali. Tutti gli approcci attualmente descritti in letteratura dipendono da una significativa diversità esistente tra le diete somministrate, che si traduce in cambiamenti misurabili della quantità di un certo marcatore o in un’alterazione caratteristica del rapporto tra gli isotopi nel latte. Di conseguenza, questi metodi non sono in grado di distinguere tra i sistemi di allevamento biologici intensivi e i sistemi convenzionali estensivi.
Conclusioni
Numerosi fattori influenzano la composizione del latte, e la conoscenza relativa alle interazioni che esistono tra di essi è limitata. Lo stesso si può dire sul gran numero di studi che mettono a confronto il latte biologico con quello convenzionale e del numero scarso di conclusioni tratte, e generalmente accettate, sulle differenze che intercorrono tra il latte biologico e quello convenzionale. Questa limitazione scaturisce per due ragioni, la prima riguarda la mancanza di requisiti confrontabili sia all’interno dello studio che tra uno studio e l’altro. In linea generale, la maggior parte dei ricercatori non ha analizzato un numero sufficiente di variabili per poter consentire la realizzazione di un valido confronto tra il latte vaccino biologico e quello convenzionale. La composizione della dieta e la razza dei bovini sono tra i fattori basilari da tenere in considerazione e da segnalare quando si cerca di confrontare i campioni di latte. La seconda ragione riguarda la normativa attualmente in uso per la produzione di latte biologico, che non consente una netta distinzione dal latte convenzionale. In altre parole, non esiste alcun “effetto biologico” attribuibile ad una combinazione olistica di fattori influenzati dal sistema biologico. Se la genetica animale, la salute, la razza, la dieta, il management o l’ambiente differiscono, la stessa cosa vale per la composizione del latte prodotto.
Ringraziamenti
Questo lavoro è stato finanziato da sovvenzioni di Fonterra Cooperative Group Limited (Nuova Zelanda), Ministry of Science and Innovation (Nuova Zelanda) e AGMARDT (Nuova Zelanda).
Riferimenti
Abdulkhaliq, A., K. M. Swaileh, R. M. Hussein, and M. Matani. 2012. Levels of metals (Cd, Pb, Cu and Fe) in cow’s milk, dairy products and hen’s eggs from the West Bank, Palestine. Int. Food Res. J. 19:1089–1094.
Abrahamse, P. A., J. Dijkstra, B. Vlaeminck, and S. Tamminga. 2008. Frequent allocation of rotationally grazed dairy cows changes grazing behavior and improves productivity. J. Dairy Sci. 91:2033–2045.
Adler, S. A., S. K. Jensen, E. Govasmark, and H. Steinshamn. 2013. Effect of short-term versus long-term grassland management and seasonal variation in organic and conventional dairy farming on the composition of bulk tank milk. J. Dairy Sci. 96:5793–5810.
Ahlman, T., B. Berglund, L. Rydhmer, and E. Strandberg. 2011. Culling reasons in organic and conventional dairy herds and genotype by environment interaction for longevity. J. Dairy Sci. 94:1568–1575. http://dx.doi.org/10.3168/jds.2010-3483.
Anacker, G. 2007. Differences between composition of organic milk and conventional milk. Lebensmitt. Milchwirtsch. 128:17–25.
Arnold, C., and G. Jahreis. 2011. Milk fat and health. Ernahrungs Umschau 58:177–181.
AsureQuality. 2013. AsureQuality Organic Standard For Primary Producers – Version 5. Page 129. AsureQuality Ltd., New Zealand.
Auldist, M. J., and I. B. Hubble. 1998. Effects of mastitis on raw milk and dairy products. Aust. J. Dairy Technol. 53:28–36.
Auldist, M. J., A. R. Napper, and E. S. Kolver. 2000. Contribution of nutrition to seasonal variation of milk composition in New Zealand Friesian and US Holstein dairy cows. Asian-australas. J. Anim. Sci. 13:513–515.
Baars, T., J. Wohlers, D. Kusche, and G. Jahreis. 2012. Experimental improvement of cow milk fatty acid composition in organic winter diets. J. Sci. Food Agric. http://dx.doi.org/10.1002/jsfa.5525.
Ballou, L. U., M. Pasquini, R. D. Bremel, T. Everson, and D. Sommer. 1995. Factors affecting herd milk composition and milk plasmin at four levels of somatic cell counts. J. Dairy Sci. 78:2186–2195.
Bartl, K., C. A. Gomez, M. García, T. Aufdermauer, M. Kreuzer, H. D. Hess, and H. R. Wettstein. 2008. Milk fatty acid profile of Peruvian Criollo and Brown Swiss cows in response to different diet qualities fed at low and high altitude. Arch. Anim. Nutr. 62:468–484. http://dx.doi.org/10.1080/17450390802453450.
Bath, S. C., S. Button, and M. P. Rayman. 2012. Iodine concentration of organic and conventional milk: Implications for iodine intake. Br. J. Nutr. 107:935–940. http://dx.doi.org/10.1017/S0007114511003059.
Benbrook, C. M., G. Butler, M. A. Latif, C. Leifert, and D. R. Davis. 2013. Organic production enhances milk nutritional quality by shifting fatty acid composition: A United States-wide, 18-month study. PLoS ONE 8:e82429. http://dx.doi.org/10.1371/journal.pone.0082429.
Bergamo, P., E. Fedele, L. Iannibelli, and G. Marzillo. 2003. Fat-soluble vitamin contents and fatty acid composition in organic and conventional Italian dairy products. Food Chem. 82:625–631. http://dx.doi.org/10.1016/s0308-8146(03)00036-0.
Bilal, G., R. I. Cue, A. F. Mustafa, and J. F. Hayes. 2012. Short communication: Estimates of heritabilities and genetic correlations among milk fatty acid unsaturation indices in Canadian Holsteins. J. Dairy Sci. 95:7367–7371. http://dx.doi.org/10.3168/jds.2012-5684.
Bilik, K., and M. Lopuszanska-Rusek. 2010. Effect of organic and conventional feeding of Red-and-White cows on productivity and milk composition. Ann. Anim. Sci. 10:441–458.
Blank, B., D. Schaub, H. M. Paulsen, and G. Rahmann. 2013. Comparison of performance and feeding parameters in organic and conventional dairy farms in Germany. Landbauforschung Volkenrode 63:21–27. (In German)
Bleck, G. T., M. B. Wheeler, L. B. Hansen, H. Chester-Jones, and D. J. Miller. 2009. Lactose synthase components in milk: Concentrations of α-lactalbumin and β1,4-galactosyltransferase in milk of cows from several breeds at various stages of lactation. Reprod. Domest. Anim. 44:241–247.
Bloksma, J., R. Adriaansen-Tennekes, M. Huber, L. P. L. van de Vijver, T. Baars, and J. de Wit. 2008. Comparison of organic and conventional raw milk quality in The Netherlands. Biol. Agric. Hortic. 26:69–83.
Boudonck, K. J., M. W. Mitchell, J. Wulff, and J. A. Ryals. 2009. Characterization of the biochemical variability of bovine milk using metabolomics. Metabolomics 5:375–386. http://dx.doi.org/10.1007/s11306-009-0160-8.
Bovolenta, S., M. Corazzin, E. Saccà, F. Gasperi, F. Biasioli, and W. Ventura. 2009. Performance and cheese quality of Brown cows grazing on mountain pasture fed two different levels of supplementation. Livest. Sci. 124:58–65. http://dx.doi.org/10.1016/j.livsci.2008.12.009.
Butler, G., J. H. Nielsen, M. K. Larsen, B. Rehberger, S. Stergiadis, A. Canever, and C. Leifert. 2011. The effects of dairy management and processing on quality characteristics of milk and dairy products. NJAS Wageningen. J. Life Sci. 58:97–102. http://dx.doi.org/10.1016/j.njas.2011.04.002.
Butler, G., J. H. Nielsen, T. Slots, C. Seal, M. D. Eyre, R. Sanderson, and C. Leifert. 2008. Fatty acid and fat-soluble antioxidant concentrations in milk from high- and low-input conventional and organic systems: Seasonal variation. J. Sci. Food Agric. 88:1431–1441. http://dx.doi.org/10.1002/jsfa.3235.
Cabrita, A. R. J., R. J. B. Bessa, S. P. Alves, R. J. Dewhurst, and A. J. M. Fonseca. 2007. Effects of dietary protein and starch on intake, milk production, and milk fatty acid profiles of dairy cows fed corn silage-based diets. J. Dairy Sci. 90:1429–1439.
Canadian General Standards Board. 2011. Organic Production Systems General Principles and Management Standards. Page 39. Standards Council of Canada.
Capuano, E., J. Rademaker, H. van den Bijgaart, and S. M. van Ruth. 2014. Verification of fresh grass feeding, pasture grazing and organic farming by FTIR spectroscopy analysis of bovine milk. Food Res. Int. 60:59–65. http://dx.doi.org/10.1016/j.foodres.2013.12.024.
Carpio, A., V. Rodríguez-Estévez, M. Sánchez-Rodríguez, L. Arce, and M. Valcárcel. 2010. Differentiation of organic goat’s milk based on its hippuric acid content as determined by capillary electrophoresis. Electrophoresis 31:2211–2217.
Carroll, S. M., E. J. DePeters, S. J. Taylor, M. Rosenberg, H. Perez- Monti, and V. A. Capps. 2006. Milk composition of Holstein, Jersey, and Brown Swiss cows in response to increasing levels of dietary fat. Anim. Feed Sci. Technol. 131:451–473.
Cmen, M., N. Yldrm, A. Dkc, O. Kaplan, and N. C. Yldrm. 2010. Seasonal variations of biochemical taste parameters in milks from conventional and environment-friendly organic farming. Bulg. J. Agric. Sci. 16: 728–732.
Coggins, P. C., M. W. Schilling, S. Kumari, and P. D. Gerrard. 2008. Development of a sensory lexicon for conventional milk yogurt in the United States. J. Sens. Stud. 23:671–687. http://dx.doi.org/10.1111/j.1745-459X.2008.00179.x.
Coleman, J., K. M. Pierce, D. P. Berry, A. Brennan, and B. Horan. 2010. Increasing milk solids production across lactation through genetic selection and intensive pasture-based feed system. J. Dairy Sci. 93:4302–4317. http://dx.doi.org/10.3168/jds.2009-2591.
Collomb, M., W. Bisig, U. Buetikofer, R. Sieber, M. Bregy, and L. Etter. 2008. Fatty acid composition of mountain milk from Switzerland: Comparison of organic and integrated farming systems. Int. Dairy J. 18:976–982.
Collomb, M., U. Bütikofer, M. Spahni, B. Jeangros, and J. O. Bosset. 1999. Fatty acid and glyceride composition of cow’s milk fat in high-and lowland regions. Sci. Aliments 19:97–110.
Coppa, M., A. Ferlay, C. Chassaing, C. Agabriel, F. Glasser, Y. Chilliard, G. Borreani, R. Barcarolo, T. Baars, D. Kusche, O. M. Harstad, J. Verbi, J. Golecký, and B. Martin. 2013. Prediction of bulk milk fatty acid composition based on farming practices collected through on-farm surveys. J. Dairy Sci. 96:4197–4211. http://dx.doi.org/10.3168/jds.2012-6379.
Coulon, J. B., I. Verdier, P. Pradel, and M. Almena. 1998. Effect of lactation stage on the cheesemaking properties of milk and the quality of Saint-Nectaire-type cheese. J. Dairy Res. 65:295–305.
Craninx, M., A. Steen, H. Van Laar, T. Van Nespen, J. Martin-Tereso, B. De Baets, and V. Fievez. 2008. Effect of lactation stage on the odd- and branched-chain milk fatty acids of dairy cattle under grazing and indoor conditions. J. Dairy Sci. 91:2662–2677. http://dx.doi.org/10.3168/jds.2007-0656.
Croissant, A. E., S. P. Washburn, L. L. Dean, and M. A. Drake. 2007. Chemical properties and consumer perception of fluid milk from conventional and pasture-based production systems. J. Dairy Sci. 90:4942–4953.
Čuboň, J., V. Foltys, P. Hašík, M. Kaániová, I. Ubrežiová, S. Krámar, and K. Vavrišínová. 2008. The raw milk quality from organic and conventional agriculture. Acta Univ. Agric. Silvic. Mendel. Brun. 56:25–30.
Dahl, L., J. A. Opsahl, H. M. Meltzer, and K. Julshamn. 2003. Iodine concentration in Norwegian milk and dairy products. Br. J. Nutr. 90:679–685. http://dx.doi.org/10.1079/bjn2003921.
Dangour, A. D., K. Lock, A. Hayter, A. Aikenhead, E. Allen, and R. Uauy. 2010. Nutrition-related health effects of organic foods: A systematic review. Am. J. Clin. Nutr. 92:203–210. http://dx.doi.org/10.3945/ajcn.2010.29269.
Daxenberger, A., D. Ibarreta, and H. H. D. Meyer. 2001. Possible health impact of animal oestrogens in food. Hum. Reprod. Update 7:340–355. http://dx.doi.org/10.1093/humupd/7.3.340.
Department for Environment, Food and Rural Affairs. 2010. Guidance Document on European Union Organic Standards. Page 31. Welsh Assembly Government; Department of Agriculture and Rural Development; The Scottish Government.
Department for Environment, Food and Rural Affairs. 2011. The Cattle Book 2008. Descriptive Statistics of Cattle Numbers in Great Britain on June 2008. Defra, London, UK.
Dunshea, F. R., G. P. Walker, E. Ostrowska, and P. T. Doyle. 2008. Seasonal variation in the concentrations of conjugated linoleic and trans fatty acids in milk fat from commercial dairy farms is associated with pasture and grazing management and supplementary feeding practices. Aust. J. Exp. Agric. 48:1062–1075. http://dx.doi.org/10.1071/ea0728610.1071/EA99132.
Elgersma, A., G. Ellen, H. Van Der Horst, H. Boer, P. R. Dekker, and S. Tamminga. 2004. Quick changes in milk fat composition from cows after transition from fresh grass to a silage diet. Anim. Feed Sci. Technol. 117:13–27. http://dx.doi.org/10.1016/j.anifeedsci.2004.08.003.
Elgersma, A., S. Tamminga, and G. Ellen. 2006. Modifying milk composition through forage. Anim. Feed Sci. Technol. 131:207–225. http://dx.doi.org/10.1016/j.anifeedsci.2006.06.012.
Ellis, K. A., G. Innocent, D. Grove-White, P. Cripps, W. G. McLean, C. V. Howard, and M. Mihm. 2006. Comparing the fatty acid composition of organic and conventional milk. J. Dairy Sci. 89:1938–1950.
Ellis, K. A., G. T. Innocent, M. Mihm, P. Cripps, W. G. McLean, C. V. Howard, and D. Grove-White. 2007a. Dairy cow cleanliness and milk quality on organic and conventional farms in the UK. J. Dairy Res. 74:302–310. http://dx.doi.org/10.1017/S002202990700249X.
Ellis, K. A., A. Monteiro, G. T. Innocent, D. Grove-White, P. Cripps, W. Graham McLean, C. V. Howard, and M. Mihm. 2007b. Investigation of the vitamins A and E and β-carotene content in milk from UK organic and conventional dairy farms. J. Dairy Res. 74:484–491. http://dx.doi.org/10.1017/S0022029907002816.
Emmett, P. M., and I. S. Rogers. 1997. Properties of human milk and their relationship with maternal nutrition. Early Hum. Dev. 49:S7–S28. http://dx.doi.org/10.1016/s0378-3782(97)00051-0.
Fall, N., and U. Emanuelson. 2011. Fatty acid content, vitamins and selenium in bulk tank milk from organic and conventional Swedish dairy herds during the indoor season. J. Dairy Res. 78:287–292. http://dx.doi.org/10.1017/S0022029911000392.
Ferlay, A., C. Agabriel, C. Sibra, C. Journal, B. Martin, and Y. Chilliard. 2008. Tanker milk variability in fatty acids according to farm feeding and husbandry practices in a French semi-mountain area. Dairy Sci. Technol 88:193–215. http://dx.doi.org/10.1051/dst:2007013.
Flowers, G., S. A. Ibrahim, and A. A. AbuGhazaleh. 2008. Milk fatty acid composition of grazing dairy cows when supplemented with linseed oil. J. Dairy Sci. 91:722–730. http://dx.doi.org/10.3168/ jds.2007-0410.
Forman, J., J. Silverstein, J. J. S. Bhatia, S. A. Abrams, M. R. Corkins, S. D. De Ferranti, N. H. Golden, J. A. Paulson, A. C. Brock-Utne, H. L. Brumberg, C. C. Campbell, B. P. Lanphear, K. C. Osterhoudt, M. T. Sandel, L. Trasande, and R. O. Wright. 2012. Organic foods: Health and environmental advantages and disadvantages. Pediatrics 130:e1406–e1415. http://dx.doi.org/10.1542/ peds.2012-2579.
Forsbäck, L., H. Lindmark-Månsson, A. Andrén, M. Åkerstedt, L. Andrée, and K. Svennersten-Sjaunja. 2010. Day-to-day variation in milk yield and milk composition at the udder-quarter level. J. Dairy Sci. 93:3569–3577.
Gabryszuk, M., K. Słoniewski, and T. Sakowski. 2008. Macro- and microelements in milk and hair of cows from conventional vs. organic farms. Anim. Sci. Pap. Rep. 26:199–209.
Gallina Toschi, T., A. Bendini, S. Barbieri, E. Valli, M. L. Cezanne, K. Buchecker, and M. Canavari. 2012. Organic and conventional nonflavored yogurts from the Italian market: Study on sensory profiles and consumer acceptability. J. Sci. Food Agric. 92:2788–2795. http://dx.doi.org/10.1002/jsfa.5666.
Garmo, R. T., S. Waage, S. Sviland, B. I. F. Henriksen, O. Østerås, and O. Reksen. 2010. Reproductive performance, udder health, and antibiotic resistance in mastitis bacteria isolated from Norwegian Red cows in conventional and organic farming. Acta Vet. Scand. 52: http://dx.doi.org/10.1186/1751-0147-52-11.
Ghidini, S., E. Zanardi, A. Battaglia, G. Varisco, E. Ferretti, G. Campanini, and R. Chizzolini. 2005. Comparison of contaminant and residue levels in organic and conventional milk and meat products from Northern Italy. Food Addit. Contam. 22:9–14. http://dx.doi.org/10.1080/02652030400027995.
Givens, D. I. 2005. The role of animal nutrition in improving the nutritive value of animal-derived foods in relation to chronic disease. Proc. Nutr. Soc. 64:395–402. http://dx.doi.org/10.1079/pns2005448.
Gołda, A., P. Szyniarowski, K. Ostrowska, A. Kozik, and M. Rapała- Kozik. 2004. Thiamine binding and metabolism in germinating seeds of selected cereals and legumes. Plant Physiol. Biochem. 42:187–195.
Gray, C. W., R. G. McLaren, and A. H. C. Roberts. 2003. Cadmium leaching from some New Zealand pasture soils. Eur. J. Soil Sci. 54:159–166. http://dx.doi.org/10.1046/j.1365-2389.2003.00495.x.
Gross, J., H. A. Van Dorland, R. M. Bruckmaier, and F. J. Schwarz. 2011. Milk fatty acid profile related to energy balance in dairy cows. J. Dairy Res. 78:479–488. http://dx.doi.org/10.1017/S0022029911000550.
Gruber, L., R. Steinwender, T. Guggenberger, J. Häusler, and A. Schauer. 2001. Comparison of organic and conventional farming on a grassland farm. Second Communication: Feed intake, milk yield, health and fertility parameters. Bodenkultur 52:55–70.
Guéguen, L., and G. Pascal. 2010. An update on the nutritional and health value of organic foods. Cahiers de Nutrition et de Dietetique 45:130–143. http://dx.doi.org/10.1016/j.cnd.2010.02.002.
Guo, J. Z., X. L. Liu, A. J. Xu, and Z. Xia. 2010. Relationship of somatic cell count with milk yield and composition in Chinese Holstein population. Agric. Sci. China 9:1492–1496.
Hanus, O., J. Brychtova, V. Gencurova, J. Pesl, I. Hulova, M. Vyletelova, R. Jedelska, and J. Kopecky. 2008a. Effect of conversion from conventional to organic dairy farm on milk quality and health of dairy cows. Folia Vet. 52:140–148.
Hanus, O., Z. Vorlicek, K. Sojkova, R. Rozsypal, M. Vyletelova, P. Roubal, V. Gencurova, J. Pozdisek, and H. Landova. 2008b. A comparison of selected milk indicators in organic herds with conventional herd as reference. Folia Vet. 52:155–159.
Haug, A., A. T. Hostmark, and O. M. Harstad. 2007. Bovine milk in human nutrition—A review. Lipids Health Disease 6:25. http://dx.doi.org/10.1186/1476-511x-6-25.
Heck, J. M. L., H. J. F. van Valenberg, J. Dijkstra, and A. C. M. van Hooijdonk. 2009. Seasonal variation in the Dutch bovine raw milk composition. J. Dairy Sci. 92:4745–4755. http://dx.doi.org/10.3168/jds.2009-2146.
Hermansen, J. E., J. H. Badsberg, T. Kristensen, and V. Gundersen. 2005. Major and trace elements in organically or conventionally produced milk. J. Dairy Res. 72:362–368. http://dx.doi.org/10.1017/S0022029905000968.
Hermansen, J. E., S. Ostersen, and O. Aaes. 1994. Effect of the levels of N fertilizer, grass and supplementary feeds on nitrogen composition and renneting properties of milk from cows at pasture. J. Dairy Res. 61:179–189.
Honorato, L. A., L. C. P. Machado Filho, I. D. Barbosa Silveira, and M. J. Hötzel. 2014. Strategies used by dairy family farmers in the south of Brazil to comply with organic regulations. J. Dairy Sci. 97:1319–1327. http://dx.doi.org/10.3168/jds.2012-6532.
Hou, J. 2011. Variations of trans octadecenoic acids, especially trans-10 C18:1 and trans-11 C18:1 in milk fat. Milchwissenschaft 66:189–192.
Jahreis, G., J. Pritsche, and H. Steinhart. 1997. Conjugated linoleic acid in milk fat: High variation depending on production system. Nutr. Res. 17:1479–1484. http://dx.doi.org/10.1016/s0271-5317(97)00138-3.
Jenkins, T. C., and M. A. McGuire. 2006. Major advances in nutrition: Impact on milk composition. J. Dairy Sci. 89:1302–1310.
Johner, S. A., K. v. Nida, G. Jahreis, and T. Remer. 2012. Time trends and seasonal variation of iodine content in German cows’ Tierarztl. Wochenschr. 125:76–82.
Juozaitiene, V., A. Zakas, and A. Juozaitis. 2004. Relationship of somatic cell count with milk yield and composition in the herds of Black-and-White cattle. Med. Weter. 60:701–704.
Kala, P. 2011. The effects of silage feeding on some sensory and health attributes of cow’s milk: A review. Food Chem. 125:307–317. http://dx.doi.org/10.1016/j.foodchem.2010.08.077.
Kay, J. K., J. R. Roche, E. S. Kolver, N. A. Thomson, and L. H. Baumgard. 2005. A comparison between feeding systems (pasture and TMR) and the effect of vitamin E supplementation on plasma and milk fatty acid profiles in dairy cows. J. Dairy Res. 72:322–332. http://dx.doi.org/10.1017/S0022029905000944.
Khiaosa-Ard, R., F. Klevenhusen, C. R. Soliva, M. Kreuzer, and F. Leiber. 2010. Transfer of linoleic and linolenic acid from feed to milk in cows fed isoenergetic diets differing in proportion and origin of concentrates and roughages. J. Dairy Res. 77:331–336. http://dx.doi.org/10.1017/S0022029910000257.
Kliem, K. E., R. Morgan, D. J. Humphries, K. J. Shingfield, and D. I. Givens. 2008. Effect of replacing grass silage with maize silage in the diet on bovine milk fatty acid composition. Animal 2:1850–1858. http://dx.doi.org/10.1017/s1751731108003078.
Kliem, K. E., K. J. Shingfield, K. M. Livingstone, and D. I. Givens. 2013. Seasonal variation in the fatty acid composition of milk available at retail in the United Kingdom and implications for dietary intake. Food Chem. 141:274–281. http://dx.doi.org/10.1016/j.foodchem.2013.02.116.
Kuczyska, B., K. Puppel, M. Gołbiewski, E. Metera, T. Sakowski, and K. Słoniewski. 2012. Differences in whey protein content between cow’s milk collected in late pasture and early indoor feeding season from conventional and organic farms in Poland. J. Sci. Food Agric. 92:2899–2904. http://dx.doi.org/10.1002/jsfa.5663.
Kuczynska, B., K. Puppel, E. Metera, P. Klis, A. Grodzka, and T. Sakowski. 2011. Fatty acid composition of milk from Brown Swiss and Holstein-Friesian black and white cows kept in a certified organic farm. Annals of Warsaw University of Life Sciences SGGW, Animal Science 49:61–67.
Larsen, M. K., X. C. Fretté, T. Kristensen, J. Eriksen, K. Søegaard, and J. H. Nielsen. 2012. Fatty acid, tocopherol and carotenoid content in herbage and milk affected by sward composition and season of grazing. J. Sci. Food Agric. http://dx.doi.org/10.1002/jsfa.5620.
Larsen, M. K., J. H. Nielsen, G. Butler, C. Leifert, T. Slots, G. H. Kristiansen, and A. H. Gustafsson. 2010. Milk quality as affected by feeding regimens in a country with climatic variation. J. Dairy Sci. 93:2863–2873. http://dx.doi.org/10.3168/jds.2009-2953.
Leiber, F., M. Kreuzer, D. Nigg, H. R. Wettstein, and M. R. L. Scheeder. 2005. A study on the causes for the elevated n-3 fatty acids in cows’ milk of alpine origin. Lipids 40:191–202. http://dx.doi.org/10.1007/s11745-005-1375-3.
Lemosquet, S., E. Delamaire, H. Lapierre, J. W. Blum, and J. L. Peyraud. 2009. Effects of glucose, propionic acid, and nonessential amino acids on glucose metabolism and milk yield in Holstein dairy cows. J. Dairy Sci. 92:3244–3257.
Licata, P., D. Trombetta, M. Cristani, F. Giofrè, D. Martino, M. Calò, and F. Naccari. 2004. Levels of “toxic” and “essential” metals in samples of bovine milk from various dairy farms in Calabria, Italy. Environ. Int. 30:1–6. http://dx.doi.org/10.1016/S0160-4120(03)00139-9.
Lindmark Månsson, H. 2008. Fatty acids in bovine milk fat. Food Nutr. Res. 52. http://dx.doi.org/10.3402/fnr.v52i0.1821.
Liu, Z., C. A. Kanter, K. D. Messer, and H. M. Kaiser. 2013. Identifying significant characteristics of organic milk consumers: A CART analysis of an artefactual field experiment. Appl. Econ. 45:3110–3121.
Lock, A. L., C. L. Preseault, J. E. Rico, K. E. DeLand, and M. S. Allen. 2013. Feeding a C16:0-enriched fat supplement increased the yield of milk fat and improved conversion of feed to milk. J. Dairy Sci. 96:6650–6659. http://dx.doi.org/10.3168/jds.2013-6892.
Loften, J. R., J. G. Linn, J. K. Drackley, T. C. Jenkins, C. G. Soderholm, and A. F. Kertz. 2014. Invited review: Palmitic and stearic acid metabolism in lactating dairy cows. J. Dairy Sci. 97:4661–4674. http://dx.doi.org/10.3168/jds.2014-7919.
Lönnerdal, B., E. Forsum, M. Gebre Medhin, and L. Hambraeus. 1976. Breast milk composition in Ethiopian and Swedish mothers. II. Lactose, nitrogen, and protein contents. Am. J. Clin. Nutr. 29:1134–1141.
Lourenço, M., G. Van Ranst, B. Vlaeminck, S. De Smet, and V. Fievez. 2008. Influence of different dietary forages on the fatty acid composition of rumen digesta as well as ruminant meat and milk. Anim. Feed Sci. Technol. 145:418–437. http://dx.doi.org/10.1016/j.anifeedsci.2007.05.043.
Macdonald, K. A., G. A. Verkerk, B. S. Thorrold, J. E. Pryce, J. W. Penno, L. R. McNaughton, L. J. Burton, J. A. S. Lancaster, J. H. Williamson, and C. W. Holmes. 2008. A comparison of three strains of Holstein-Friesian grazed on pasture and managed under different feed allowances. J. Dairy Sci. 91:1693–1707. http://dx.doi.org/10.3168/jds.2007-0441.
Mackle, T. R., C. R. Parr, and A. M. Bryant. 1996. Nitrogen fertilizer effects on milk yield and composition, pasture intake, nitrogen and energy partitioning, and rumen fermentation parameters of dairy cows in early lactation. N.Z. J. Agric. Res. 39:341–356.
Magkos, F., F. Arvaniti, and A. Zampelas. 2003. Organic food: Nutritious food or food for thought? A review of the evidence. Int. J. Food Sci. Nutr. 54:357–371. http://dx.doi.org/10.1080/09637480120092071.
Malekinejad, H., P. Scherpenisse, and A. A. Bergwerff. 2006. Naturally occurring estrogens in processed milk and in raw milk (from gestated cows). J. Agric. Food Chem. 54:9785–9791. http://dx.doi.org/10.1021/jf061972e.
Managi, S., Y. Yamamoto, H. Iwamoto, and K. Masuda. 2008. Valuing the influence of underlying attitudes and the demand for organic milk in Japan. Agric. Econ. 39:339–348. http://dx.doi.org/10.1111/j.1574-0862.2008.00337.x.
Maréchal, C. L., R. Thiéry, E. Vautor, and Y. L. Loir. 2011. Mastitis impact on technological properties of milk and quality of milk products—A review. Dairy Sci. Technol. 91:247–282.
Maurice-Van Eijndhoven, M. H. T., S. J. Hiemstra, and M. P. L. Calus. 2011. Short communication: Milk fat composition of 4 cattle breeds in the Netherlands. J. Dairy Sci. 94:1021–1025. http://dx.doi.org/10.3168/jds.2009-3018.
McKenzie, F. R., and J. L. Jacobs. 2002. Effects of application of nitrogen fertilizer on concentrations of P, K, S, Ca, Mg, Na, Cl, Mn, Fe, Cu and Zn in perennial ryegrass/white clover pastures in southwestern Victoria, Australia. Grass Forage Sci. 57:48–53.
Miller, L. A., J. M. Moorby, D. R. Davies, M. O. Humphreys, N. D. Scollan, J. C. MacRae, and M. K. Theodorou. 2001. Increased concentration of water-soluble carbohydrate in perennial ryegrass (Lolium perenne L.): Milk production from late-lactation dairy cows. Grass Forage Sci. 56:383–394. http://dx.doi.org/10.1046/j.1365- 2494.2001.00288.x.
Ministry of Agriculture, Forestry and Fisheries. 2012. Japanese Agricultural Standard for Organic Livestock Products. Notification No. 1608 of the Ministry of Agriculture, Forestry and Fisheries of October 27, 2005. Partial Revision 2012:17.
Mirlean, N., P. Baisch, I. Machado, and E. Shumilin. 2008. Mercury contamination of soil as the result of long-term phosphate fertilizer production. Bull. Environ. Contam. Toxicol. 81:305–308. http://dx.doi.org/10.1007/s00128-008-9480-z.
Mogensen, L., T. Kristensen, K. Søegaard, S. K. Jensen, and J. Sehested. 2012. Alfa-tocopherol and beta-carotene in roughages and milk in organic dairy herds. Livest. Sci. 145:44–54. http://dx.doi.org/10.1016/j.livsci.2011.12.021.
Molkentin, J. 2008. Laboratory authentication of organic milk. Deutsche Milchwirtschaft 59:873–874.
Molkentin, J. 2009. Authentication of organic milk using 13C and the alpha-linolenic acid content of milk fat. J. Agric. Food Chem. 57:785–790.
Molkentin, J., and A. Giesemann. 2007. Differentiation of organically and conventionally produced milk by stable isotope and fatty acid analysis. Anal. Bioanal. Chem. 388:297–305.
Moorby, J. M., M. R. F. Lee, D. R. Davies, E. J. Kim, G. R. Nute, N. M. Ellis, and N. D. Scollan. 2009. Assessment of dietary ratios of red clover and grass silages on milk production and milk quality in dairy cows. J. Dairy Sci. 92:1148–1160. http://dx.doi.org/10.3168/jds.2008-1771.
Mullen, K. A. E., L. G. Sparks, R. L. Lyman, S. P. Washburn, and K. L. Anderson. 2013. Comparisons of milk quality on North Carolina organic and conventional dairies. J. Dairy Sci. 96:6753–6762. http://dx.doi.org/10.3168/jds.2012-6519.
Muller, U., and I. Lehmann. 2007. Factors influencing animal health and milk quality. Ökologie & Landbau 142:40–41.
Müller, U., and H. Sauerwein. 2010. A comparison of somatic cell count between organic and conventional dairy cow herds in West Germany stressing dry period related changes. Livest. Sci. 127:30–37. http://dx.doi.org/10.1016/j.livsci.2009.08.003.
Muller-Lindenlauf, M., C. Deittert, and U. Kopke. 2010. Assessment of environmental effects, animal welfare and milk quality among organic dairy farms. Livest. Sci. 128:140–148. http://dx.doi.org/10.1016/j.livsci.2009.11.013.
Mut, H., I. Ayan, Z. Acar, U. Basaran, Ö. Töngel, and O. Asci. 2009. Relationship between soil structure and botanical composition of the flat pastures in coastal region of Samsun province. Asian J. Chem. 21:971–978.
Nagpal, R., H. Yadav, A. K. Puniya, K. Singh, S. Jain, and F. Marotta. 2007. Conjugated linoleic acid: Sources, synthesis and potential health benefits—An overview. Curr. Top. Nutraceut. Res. 5:55–65.
Nantapo, C. T. W., V. Muchenje, and A. Hugo. 2014. Atherogenicity index and health-related fatty acids in different stages of lactation from Friesian, Jersey and Friesian×Jersey cross cow milk under a pasture-based dairy system. Food Chem. 146:127–133. http://dx.doi.org/10.1016/j.foodchem.2013.09.009.
Nauta, W. J., T. Baars, H. Saatkamp, D. Weenink, and D. Roep. 2009. Farming strategies in organic dairy farming: Effects on breeding goal and choice of breed. An explorative study. Livest. Sci. 121:187–199. http://dx.doi.org/10.1016/j.livsci.2008.06.011.
Nauta, W. J., R. F. Veerkamp, E. W. Brascamp, and H. Bovenhuis. 2006. Genotype by environment interaction for milk production traits between organic and conventional dairy cattle production in The Netherlands. J. Dairy Sci. 89:2729–2737.
Nygaard, H. 2007. Farming and milk production in Denmark. In 27th European Holstein and Red Holstein Conference, 2007 World Holstein Friesian Federation. Danish Cattle Federation, Danish Agricultural Advisory Centre. Accessed Nov. 27, 2014. http://www.whff.info/info/conferences/ehc2007/02%20Farming%20and%20 milk%20production%20in%20Denmark.pdf.
O’Donnell, A. M., K. P. Spatny, J. L. Vicini, and D. E. Bauman. 2010. Survey of the fatty acid composition of retail milk differing in label claims based on production management practices. J. Dairy Sci. 93:1918–1925. http://dx.doi.org/10.3168/jds.2009-2799.
Ogola, H., A. Shitandi, and J. Nanua. 2007. Effect of mastitis on raw milk compositional quality. J. Vet. Sci. 8:237–242.
Organic Industry Standards and Certification Committee. 2013. National Standard for Organic and Bio-Dynamic Produce—Edition 3.5. Page 74. Department of Agriculture, Australia.
Palladino, R. A., F. Buckley, R. Prendiville, J. J. Murphy, J. Callan, and D. A. Kenny. 2010. A comparison between Holstein-Friesian and Jersey dairy cows and their F1 hybrid on milk fatty acid composition under grazing conditions. J. Dairy Sci. 93:2176–2184.
Palupi, E., A. Jayanegara, A. Ploeger, and J. Kahl. 2012. Comparison of nutritional quality between conventional and organic dairy products: A meta-analysis. J. Sci. Food Agric. http://dx.doi.org/10.1002/jsfa.5639.
Pape-Zambito, D. A., R. F. Roberts, and R. S. Kensinger. 2010. Estrone and 17 beta-estradiol concentrations in pasteurized-homogenized milk and commercial dairy products. J. Dairy Sci. 93:2533–2540.
Percival, H. J. 2003. Soil and soil solution chemistry of a New Zealand pasture soil amended with heavy metal-containing sewage sludge. Aust. J. Soil Res. 41:1–17. http://dx.doi.org/10.1071/sr01061.
Phillips, C. J. C., P. C. Chiy, D. R. Arney, and O. Kärt. 2000. Effects of sodium fertilizers and supplements on milk production and mammary gland health. J. Dairy Res. 67:1–12.
Piccand, V., E. Cutullic, S. Meier, F. Schori, P. L. Kunz, J. R. Roche, and P. Thomet. 2013. Production and reproduction of Fleckvieh, Brown Swiss, and 2 strains of Holstein-Friesian cows in a pasturebased, seasonal-calving dairy system. J. Dairy Sci. 96:5352–5363. http://dx.doi.org/10.3168/jds.2012-6444.
Pilarczyk, B., R. Pilarczyk, A. Tomza-Marciniak, A. Kowieska, J. Wojcik, P. Sablik, A. Tylkowska, and D. Hendzel. 2011. Selenium concentrations in the serum and milk of cows from organic and conventional farms in West Pomerania. Tierarztl. Umsch. 64:327–331.
Pilarczyk, R., J. Wójcik, P. Czerniak, P. Sablik, B. Pilarczyk, and A. Tomza-Marciniak. 2013. Concentrations of toxic heavy metals and trace elements in raw milk of Simmental and Holstein-Friesian cows from organic farm. Environ. Monit. Assess. 185:8383–8392. http://dx.doi.org/10.1007/s10661-013-3180-9.
Powers, H. J. 2003. Riboflavin (vitamin B-2) and health. Am. J. Clin. Nutr. 77:1352–1360.
Prandini, A., S. Sigolo, and G. Piva. 2009. Conjugated linoleic acid (CLA) and fatty acid composition of milk, curd and Grana Padano cheese in conventional and organic farming systems. J. Dairy Res. 76:278–282. http://dx.doi.org/10.1017/S0022029909004099.
Qin, L. Q., X. P. Wang, W. Li, X. Tong, and W. J. Tong. 2009. The minerals and heavy metals in cow’s milk from China and Japan. J. Health Sci. 55:300–305. http://dx.doi.org/10.1248/jhs.55.300.
Ramalho, H. M., S. D. Campos, S. Casal, R. Alves, and M. B. P. Oliveira. 2012. Lipid fraction quality of milk produced by Minhota (Portuguese autochthonous breed) compared to Holstein Friesian cow’s. J. Sci. Food Agric. http://dx.doi.org/10.1002/jsfa.5713.
Rego, O. A., H. J. D. Rosa, S. M. Regalo, S. P. Alves, C. M. M. Alfaia, J. A. M. Prates, C. M. Vouzela, and R. J. B. Bessa. 2008. Seasonal changes of CLA isomers and other fatty acids of milk fat from grazing dairy herds in the Azores. J. Sci. Food Agric. 88:1855–1859. http://dx.doi.org/10.1002/jsfa.3289.
Revello Chion, A., E. Tabacco, D. Giaccone, P. G. Peiretti, G. Battelli, and G. Borreani. 2010. Variation of fatty acid and terpene profiles in mountain milk and “Toma piemontese” cheese as affected by diet composition in different seasons. Food Chem. 121:393–399. http://dx.doi.org/10.1016/j.foodchem.2009.12.048.
Rey-Crespo, F., M. Miranda, and M. López-Alonso. 2013. Essential trace and toxic element concentrations in organic and conventional milk in NW Spain. Food Chem. Toxicol. 55:513–518. http:// dx.doi.org/10.1016/j.fct.2013.01.040.
Richert, R. M., K. M. Cicconi, M. J. Gamroth, Y. H. Schukken, K. E. Stiglbauer, and P. L. Ruegg. 2013. Management factors associated with veterinary usage by organic and conventional dairy farms. J. Am. Vet. Med. Assoc. 242:1732–1743. http://dx.doi.org/10.2460/javma.242.12.1732.
Rius, A. G., J. A. D. R. N. Appuhamy, J. Cyriac, D. Kirovski, O. Becvar, J. Escobar, M. L. McGilliard, B. J. Bequette, R. M. Akers, and M. D. Hanigan. 2010. Regulation of protein synthesis in mammary glands of lactating dairy cows by starch and amino acids. J. Dairy Sci. 93:3114–3127. http://dx.doi.org/10.3168/jds.2009-2743.
Roche, J. R., L. R. Turner, J. M. Lee, D. C. Edmeades, D. J. Donaghy, K. A. Macdonald, J. W. Penno, and D. P. Berry. 2009. Weather, herbage quality and milk production in pastoral systems. 4. Effects on dairy cattle production. Anim. Prod. Sci. 49:222–232. http://dx.doi.org/10.1071/ea07310.
Roderick, S., and J. Burke. 2004. Organic farming in Cornwall. Results of the 2002 Farmer Survey. Organic Studies Centre, Cornwall, UK.
Roesch, M., M. G. Doherr, and J. W. Blum. 2005. Performance of dairy cows on Swiss farms with organic and integrated production. J. Dairy Sci. 88:2462–2475.
Roesch, M., M. G. Doherr, W. Schären, M. Schällibaum, and J. W. Blum. 2007. Subclinical mastitis in dairy cows in Swiss organic and conventional production systems. J. Dairy Res. 74:86–92. http://dx.doi.org/10.1017/S002202990600210X.
Rosati, A., and A. Aumaitre. 2004. Organic dairy farming in Europe. Livest. Prod. Sci. 90:41–51. http://dx.doi.org/10.1016/j.livprodsci.2004.07.005.
Sapru, A., D. M. Barbano, J. J. Yun, L. R. Klei, P. A. Oltenacu, and D. K. Bandler. 1997. Cheddar cheese: Influence of milking frequency and stage of lactation on composition and yield. J. Dairy Sci. 80:437–446.
Schonfeldt, H. C., N. G. Hall, and L. E. Smit. 2012. The need for country specific composition data on milk. Food Res. Int. 47:207–209. http://dx.doi.org/10.1016/j.foodres.2011.05.018.
Schroder, M., F. Yousefi, and W. Vetter. 2011. Investigating the dayto- day variations of potential marker fatty acids for organic milk in milk from conventionally and organically raised cows. Eur. Food Res. Technol. 232:167–174.
Shahbazkia, H. R., M. Aminlari, A. Tavasoli, A. R. Mohamadnia, and A. Cravador. 2010. Associations among milk production traits and glycosylated haemoglobin in dairy cattle; Importance of lactose synthesis potential. Vet. Res. Commun. 34:1–9. http://dx.doi.org/10.1007/s11259-009-9324-2.
Simopoulos, A. P. 2003. Importance of the ratio of ω-6 /ω-3 essential fatty acids: Evolutionary aspects. World Rev. Nutr. Diet. 92:1–22.
Simopoulos, A. P. 2010. The ω-6 /ω-3 fatty acid ratio: Health implications. Ol. Corps Gras Lipides 17:267–275. http://dx.doi.org/10.1684/ocl.2010.0325.
Slots, T., G. Butler, C. Leifert, T. Kristensen, L. H. Skibsted, and J. H. Nielsen. 2009. Potentials to differentiate milk composition by different feeding strategies. J. Dairy Sci. 92:2057–2066. http://dx.doi.org/10.3168/jds.2008-1392.
Slots, T., J. Sorensen, and J. H. Nielsen. 2008. Tocopherol, carotenoids and fatty acid composition in organic and conventional milk. Milchwissenschaft 63:352–355.
Smith, K. M., P. W. Abrahams, M. P. Dagleish, and J. Steigmajer. 2009. The intake of lead and associated metals by sheep grazing mining-contaminated floodplain pastures in mid-Wales, UK: I. Soil ingestion, soil-metal partitioning and potential availability to pasture herbage and livestock. Sci. Total Environ. 407:3731–3739. http://dx.doi.org/10.1016/j.scitotenv.2009.02.032.
Smith-Spangler, C., M. L. Brandeau, G. E. Hunter, J. Clay Bavinger, M. Pearson, P. J. Eschbach, V. Sundaram, H. Liu, P. Schirmer, C. Stave, I. Olkin, and D. M. Bravata. 2012. Are organic foods safer or healthier than conventional alternatives? A systematic review. Ann. Intern. Med. 157:348–366.
Soyeurt, H., P. Dardenne, F. Dehareng, C. Bastin, and N. Gengler. 2008. Genetic parameters of saturated and monounsaturated fatty acid content and the ratio of saturated to unsaturated fatty acids in bovine milk. J. Dairy Sci. 91:3611–3626. http://dx.doi.org/10.3168/jds.2007-0971.
Soyeurt, H., P. Dardenne, A. Gillon, C. Croquet, S. Vanderick, P. Mayeres, C. Bertozzi, and N. Gengler. 2006. Variation in fatty acid contents of milk and milk fat within and across breeds. J. Dairy Sci. 89:4858–4865.
Soyeurt, H., A. Gillon, S. Vanderick, P. Mayeres, C. Bertozzi, and N.Gengler. 2007. Estimation of heritability and genetic correlations for the major fatty acids in bovine milk. J. Dairy Sci. 90:4435–4442. http://dx.doi.org/10.3168/jds.2007-0054.
Steinshamn, H., and E. Thuen. 2008. White or red clover-grass silage in organic dairy milk production: Grassland productivity and milk production responses with different levels of concentrate. Livest. Sci. 119:202–215. http://dx.doi.org/10.1016/j.livsci.2008.04.004.
Stergiadis, S., C. J. Seal, C. Leifert, M. D. Eyre, M. K. Larsen, and G. Butler. 2013. Variation in nutritionally relevant components in retail Jersey and Guernsey whole milk. Food Chem. 139:540–548. http://dx.doi.org/10.1016/j.foodchem.2013.01.078.
Stiglbauer, K. E., K. M. Cicconi-Hogan, R. Richert, Y. H. Schukken, P. L. Ruegg, and M. Gamroth. 2013. Assessment of herd management on organic and conventional dairy farms in the United States. J. Dairy Sci. 96:1290–1300. http://dx.doi.org/10.3168/jds.2012-5845.
Stoop, W. M., H. Bovenhuis, J. M. L. Heck, and J. A. M. van Arendonk. 2009. Effect of lactation stage and energy status on milk fat composition of Holstein-Friesian cows. J. Dairy Sci. 92:1469–1478. http://dx.doi.org/10.3168/jds.2008-1468.
Sundberg, T., B. Berglund, L. Rydhmer, and E. Strandberg. 2009. Fertility, somatic cell count and milk production in Swedish organic and conventional dairy herds. Livest. Sci. 126:176–182. http://dx.doi.org/10.1016/j.livsci.2009.06.022.
Sundberg, T., L. Rydhmer, W. F. Fikse, B. Berglund, and E. Strandberg. 2010. Genotype by environment interaction of Swedish dairy cows in organic and conventional production systems. Acta Agric. Scand. A Anim. Sci. 60:65–73. http://dx.doi.org/10.1080/09064702.2010.496003.
Swensson, C., and H. Lindmark-Mansson. 2007. The prospect of obtaining beneficial mineral and vitamin contents in cow’s milk through feed. J. Anim. Feed Sci. 16:21–41.
Toledo, P., A. Andren, and L. Bjorck. 2002. Composition of raw milk from sustainable production systems. Int. Dairy J. 12:75–80. http://dx.doi.org/10.1016/s0958-6946(01)00148-0.
Trachsel, P., A. Busato, and J. W. Blum. 2000. Body conditions scores of dairy cattle in organic farms. J. Anim. Physiol. Anim. Nutr. (Berl.) 84:112–124.
Tu, W. C., R. J. Cook-Johnson, M. J. James, B. S. Muhlhausler, and R. A. Gibson. 2010. Ω-3 long chain fatty acid synthesis is regulated more by substrate levels than gene expression. Prostaglandins Leukot. Essent. Fatty Acids 83:61–68. http://dx.doi.org/10.1016/j.plefa.2010.04.001.
US Government Printing Office. 2014. Electronic Code of Federal Regulations: Regulations of the Department of Agriculture: Subchapter M–Organic Foods Production Act Provisions. Vol. 2014.
Vaarst, M., and T. W. Bennedsgaard. 2001. Reduced medication in organic farming with emphasis on organic dairy production. Acta Vet. Scand. Suppl. 95:51–57. http://dx.doi.org/10.1186/1751-0147-43-S1-S51.
Valle, P. S., G. Lien, O. Flaten, M. Koesling, and M. Ebbesvik. 2007. Herd health and health management in organic versus conventional dairy herds in Norway. Livest. Sci. 112:123–132. http://dx.doi.org/10.1016/j.livsci.2007.02.005.
van Hulzen, K. J. E., R. C. Sprong, R. van der Meer, and J. A. M. van Arendonk. 2009. Genetic and nongenetic variation in concentration of selenium, calcium, potassium, zinc, magnesium, and phosphorus in milk of Dutch Holstein-Friesian cows. J. Dairy Sci. 92:5754–5759. http://dx.doi.org/10.3168/jds.2009-2406.
Vanhatalo, A., T. Gaddnas, and T. Heikkila. 2006. Microbial protein synthesis, digestion and lactation responses of cows to grass or grass-red clover silage diet supplemented with barley or oats. Agric. Food Sci. 15:252–267. http://dx.doi.org/10.2137/14596060677.
Vetter, W., and M. Schroder. 2010. Concentrations of phytanic acid and pristanic acid are higher in organic than in conventional dairy products from the German market. Food Chem. 119:746–752. http://dx.doi.org/10.1016/j.foodchem.2009.07.027.
Vicini, J., T. Etherton, P. Kris-Etherton, J. Ballam, S. Denham, R. Staub, D. Goldstein, R. Cady, M. McGrath, and M. Lucy. 2008. Survey of retail milk composition as affected by label claims regarding farm-management practices. J. Am. Diet. Assoc. 108:1198–1203.
Villeneuve, M. P., Y. Lebeuf, R. Gervais, G. F. Tremblay, J. C. Vuillemard, J. Fortin, and P. Y. Chouinard. 2013. Milk volatile organic compounds and fatty acid profile in cows fed timothy as hay, pasture, or silage. J. Dairy Sci. 96:7181–7194. http://dx.doi. org/10.3168/jds.2013-6785.
Vlaeminck, B., V. Fievez, A. R. J. Cabrita, A. J. M. Fonseca, and R. J. Dewhurst. 2006. Factors affecting odd- and branched-chain fatty acids in milk: A review. Anim. Feed Sci. Technol. 131:389–417. http://dx.doi.org/10.1016/j.anifeedsci.2006.06.017.
Vyas, D., B. B. Teter, and R. A. Erdman. 2012. Milk fat responses to dietary supplementation of short- and medium-chain fatty acids in lactating dairy cows. J. Dairy Sci. 95:5194–5202. http://dx.doi.org/10.3168/jds.2011-5277.
Waiblinger, S., C. Menke, and G. Coleman. 2002. The relationship between attitudes, personal characteristics and behaviour of stock people and subsequent behaviour and production of dairy cows. Appl. Anim. Behav. Sci. 79:195–219. http://dx.doi.org/10.1016/s0168-1591(02)00155-7.
Walker, G. P., F. R. Dunshea, and P. T. Doyle. 2004. Effects of nutrition and management on the production and composition of milk fat and protein: A review. Aust. J. Agric. Res. 55:1009–1028.
Wang, C., J. X. Liu, Z. P. Yuan, Y. M. Wu, S. W. Zhai, and H. W. Ye. 2007. Effect of level of metabolizable protein on milk production and nitrogen utilization in lactating dairy cows. J. Dairy Sci. 90:2960–2965.
Ward, N. I., R. R. Brooks, E. Roberts, and C. R. Boswell. 1977. Heavy-metal pollution from automotive emissions and its effect on roadside soils and pasture species in New Zealand. Environ. Sci. Technol. 11:917–920.
Wijesundera, C., Z. Shen, W. J. Wales, and D. E. Dalley. 2003. Effect of cereal grain and fibre supplements on the fatty acid composition of milk fat of grazing dairy cows in early lactation. J. Dairy Res. 70:257–265. http://dx.doi.org/10.1017/s0022029903006241.
Wiking, L., P. K. Theil, J. H. Nielsen, and M. T. Sorensen. 2010. Effect of grazing fresh legumes or feeding silage on fatty acids and enzymes involved in the synthesis of milk fat in dairy cows. J. Dairy Res. 77:337–342. http://dx.doi.org/10.1017/S002202991000021X.
Zagorska, J., and I. Ciprovica. 2005. The comparison of chemical pollution between organic and conventional milk. Pages 196–198 in Int. Sci. Conf. Proc., Univ of Agric., Latvia.
Zagorska, J., and I. Ciprovica. 2008. The chemical composition of organic and conventional milk in Latvia. Proc. 3rd Baltic Conference on Food Science and Technology. (FOODBALT-2008). Latvia University of Agriculture Faculty of Food Technology. 10–14.
Załecka, A., S. Bugel, F. Paoletti, J. Kahl, A. Bonanno, A. Dostalova, and G. Rahmann. 2014. The influence of organic production on food quality—Research findings, gaps and future challenges. J. Sci. Food Agric. http://dx.doi.org/10.1002/jsfa.6578.
J. Dairy Sci. 98 :721–746
Doi: dx.doi.org/ 10.3168/jds.2014-8389
© American Dairy Science Association®, 2015