International Journal of Food Science and Technology 2019
Invited Review
Lujuan Xing,1 Rui Liu,2 Songmin Cao,1 Wangang Zhang1* & Zhou Guanghong1
1 Key Lab of Meat Processing and Quality Control, College of Food Science and Technology, Jiangsu Collaborative Innovation Center of Meat Production and Processing, Quality and Safety Control, College of Food Science and Technology, Nanjing Agricultural University, Nanjing, Jiangsu 210095, Cina
2 College of Food Science and Engineering, Yangzhou University, Yangzhou 225127, Jiangsu, Cina
(Ricevuto il 31 Ottobre 2018; Accettato in revisione dal 26 Gennaio 2019)
Sommario
Introduzione
La produzione dei peptidi bioattivi dalla carne
Identificazione dei peptidi bioattivi nelle proteine della carne
Le funzioni dei peptidi derivati dalla carne
Conclusione
Ringraziamenti
Bibliografia
Sommario: con il termine generico di peptidi bioattivi vengono nominate delle brevi sequenze di aminoacidi, che derivano dall’idrolisi delle proteine presenti nella carne di manzo, di suino, di montone, di pollo, di anatra e in quella di varie specie di organismi marini. L’essiccazione, la stagionatura, l’affinatura, la maturazione e la fermentazione sono procedure particolari utili a donare sapore alla carne ma sono importanti anche per il rilascio di peptidi bioattivi dalle proteine di partenza. Una volta rilasciati, i peptidi giocherebbero un ruolo bioattivo che va oltre il loro valore nutrizionale. È stato dimostrato che le funzioni dei peptidi derivati dalla carne comprendono effetti antiossidanti, antiipertensivi, antibatterici, oppioide-simili, antitrombotici e molti altri. La regolazione delle risposte immunitarie, gastrointestinali e neurologiche operata da quei peptidi bioattivi è la base essenziale da cui partire per la prevenzione di ipertensione, obesità, diabete e di altri disturbi metabolici. In questa review, abbiamo riassunto gli studi recenti condotti sui peptidi bioattivi derivati dalla carne e sulle loro funzioni fisiologiche, per fornire un quadro generale dei benefici che questi peptidi potrebbero avere sulla salute.
Parole chiave: Antiipertensivo, antibatterico, antiossidante, peptidi bioattivi, proteine della carne
Introduzione
In seguito alla stimolazione operata da radiazioni, sostanze chimiche, tabacco, stress ed invecchiamento, le specie reattive dell’ossigeno (ROS) andrebbero ad accumularsi e causerebbero una grave ossidazione ed infiammazione delle cellule in grado di indurre la comparsa di sindrome metabolica, che incrementa il rischio di sviluppare malattie croniche come le malattie cardiovascolari (CVD), il diabete di tipo II, l’ipertensione e l’obesità (Fulop et al., 2006). Secondo le stime dell’Organizzazione Mondiale della Sanità, la CVD è diventata la principale causa di morte in tutto il mondo e i fattori di rischio includono ipertensione, colesterolo alto, tabagismo, storia familiare di malattie cardiovascolari, diabete e sovrappeso (Organizzazione 2011). Oltre allo sforzo fatto per studiare nuovi farmaci, la ricerca pone molta attenzione anche sui nutrienti acquisiti con la dieta e sulla prevenzione delle malattie croniche, in modo tale da incrementare il livello di salute degli individui. Per questo, i peptidi bioattivi derivati dagli alimenti sono considerati un punto chiave visti anche i loro effetti mitigatori sulla generazione di ROS e visto il fatto che sono in grado di migliorare le capacità antiossidanti degli organismi. Oltre ad un grande numero di sostanze fitochimiche provenienti dalle piante, sono già stati studiati (viste le loro proprietà fisiologiche) anche alcuni peptidi derivati dalla carne, tra cui la carnosina, l’anserina ed altre numerose sequenze aminoacidiche. Prima di essere rilasciati dalle loro proteine originarie, la maggior parte di questi peptidi si trovano in fase di latenza e non hanno alcun effetto bioattivo; la loro potenziale attivazione sarebbe determinata dalla digestione gastrointestinale (GI) o dalla lavorazione del cibo mediante processi come l’essiccazione, la stagionatura, la fermentazione e l’idrolisi enzimatica. Secondo studi in vitro, i peptidi derivanti dalla carne vengono ampiamente studiati per le loro proprietà antiipertensive ed antiossidanti, che stanno alla base del loro impiego per il miglioramento della salute umana. Pertanto, secondo l’opinione pubblica in generale, le proteine della carne hanno possibili proprietà bioattive oltre ad un contenuto ben bilanciato di aminoacidi essenziali. Secondo la teoria della funzionalità strutturale, la diversa attività dei peptidi è imprescindibile dalla composizione aminoacidica, dal tipo di amminoacido terminale, dalla lunghezza della catena, dal peso molecolare complessivo, dalle proprietà idrofobiche e dalla struttura spaziale (Li & Yu, 2015). In linea generale i peptidi anti-ipertensivi sarebbero per lo più costituiti da amminoacidi idrofobici e a livello N-terminale avrebbero più aminoacidi aromatici o alcalini (Escudero et al., 2013a). Comunemente, un basso punto isoelettrico (PI, 3-6) dei peptidi bioattivi è associato ad una migliore attività antiossidante ed anti-ipertensiva (Park et al., 2008; Lafarga et al., 2014). Allo steso tempo, la presenza di tirosina (Tyr), glutammato (Glu) ed acido aspartico (Asp) aumenterebbe l’attività antiossidante della sequenza peptidica, viste le loro eccellenti proprietà di attrarre gli elettroni. LDQW, LPHSGY, LLGPGLTNHA e LPHSGY sono peptidi antiossidanti con leucina (Leu) in posizione N-terminale che migliorerebbe l’interazione tra il peptide e l’acido grasso e favorirebbe la loro capacità di catturare i radicali liberi lipidici (Je et al., 2005; Byun et al ., 2009; Sadat et al., 2011; Li & Yu, 2015). Grazie a studi in vitro, è stata ampiamente dimostrata la bioattività dei peptidi derivati dalla carne che si comportano come antiossidanti, antimicrobici, antitrombotici, sostanze simili agli oppioidi, chelanti de minerali, antipertensivi ed altro ancora (Zhang et al., 2010; Hu et al., 2016). Inoltre, in base alle loro proprietà strutturali, molti peptidi bioattivi possiedono numerose proprietà differenti che ci permetterebbero di garantire molteplici applicazioni a livello di produzione di alimenti funzionali (Korhonen & Pihlanto, 2006; Dziuba & Dziuba, 2010). Al fine di aggiornare la ricerca in atto sui peptidi bioattivi derivanti dalla carne, abbiamo riassunto gli studi più recenti che si occupavano di questo argomento ponendo l’accento sulla potenziale attività fisiologica dei peptidi bioattivi, sperando di far comprendere all’opinione generale la loro importanza circa i benefici che avrebbero per la salute.
La produzione dei peptidi bioattivi dalla carne
Come fonte di peptidi bioattivi, vengono comunemente scelte proteine provenienti dai muscoli di suini, caprini, bovini, ovini e pollame. In base a caratteristiche di solubilità, le proteine muscolari possono essere suddivise in tre gruppi: miofibrillari, sarcoplasmatiche e stromali. Queste rappresentano, rispettivamente, il 60%, il 35% e il 15% circa delle proteine, e possono variare a seconda della specie e delle parti della carcassa prese in esame (Xiong, 2018). Quando parliamo di carne, la pelle, le ossa e il sangue appartengono alla categoria dei sottoprodotti animali, ma anche da questi è potenzialmente possibile ricavare peptidi bioattivi dopo idrolisi delle proteine. Essendo sensibile alle variazioni di temperatura e del pH, la struttura delle proteine può essere facilmente distrutta durante la lavorazione della carne, anche durante la stagionatura, l’essiccatura, la salatura, la fermentazione, lo stoccaggio, il congelamento e la cottura. Perciò, la produzione di peptidi bioattivi si baserebbe anche sulle modificazioni dei valori di temperatura e di pH che distruggono la struttura spaziale o che rompono la catena aminoacidica che costituisce le proteine (Lafarga et al., 2014). Inoltre, anche gli enzimi presenti all’interno della carne favorirebbero la rottura della catena proteica e la generazione di piccoli peptidi durante il processo di frollatura della carcassa (Huff-Lonergan et al., 2010). È stato visto che la quantità di peptidi bioattivi e di amminoacidi liberi aumentava durante un processo di frollatura della carne bovina fresca durato 14 giorni (Bauchart et al., 2006). Nell’industria della lavorazione della carne, lo stoccaggio in celle frigorifere è comune ed ha lo scopo di mantenere intatta la freschezza dei prodotti a base di carne. Tuttavia, il congelamento della carne potrebbe portare alla formazione di cristalli di ghiaccio che potrebbero andare a denaturare la struttura della catena proteica, come anche le variazioni di temperatura durante il processo di congelamento. Pertanto, a seconda della temperatura e del tempo di conservazione, durante il congelamento dei prodotti a base di carne si potrebbero generare alcuni peptidi (Leygonie et al., 2012). Per favorire la degradazione della struttura proteica e la produzione di peptidi bioattivi, il processo più comunemente scelto è rappresentato dall’idrolisi enzimatica. Gli enzimi digestivi comprendono principalmente pepsina, tripsina, pancreatina, Alcalase, chimotripsina, termolisina, papaina e Flavourzyme (Mora et al., 2014; Liu et al., 2016). Poiché diversi enzimi hanno specifici siti bersaglio sulla sequenza di una particolare proteina, la tipologia di enzima impiegato è abbastanza cruciale per il rilascio di peptidi. Tra tutti gli enzimi, la pepsina, la tripsina e la pancreatina vengono generalmente impiegati nella ricerca per simulare la digestione gastrointestinale e l’idrolisi del muscolo del petto del pollo e dell’anatra, del muscolo suino, del muscolo che costituisce la punta di petto del bovino, del muscolo di cervo e di alcuni prodotti a base di carne come il prosciutto stagionato (Saiga et al., 2003; Escudero et al., 2012; Lafarga & Hayes, 2014). Nell’industria alimentare, Alcalase, Flavourzyme e Protamex sono i più ampiamente utilizzati per ottenere peptidi da proteine di anatra, pollo, suino, capra e pancetta (Yanfeng & Li, 2006; Lee et al., 2010; Wang et al., 2015; Mirdhayati et al., 2016). Un complesso di proteasi viene utilizzato anche per l’idrolisi delle proteine che costituiscono la gelatina ottenuta dall’anatra e la pelle di bovino (Kim et al., 2001; Lee et al., 2012). Grazie all’attività di enzimi esogeni, i peptidi verrebbero rilasciati anche dai prodotti a base di carne stagionata. La produzione dei peptidi viene influenzata dalla tipologia di muscolo, dai metodi di stagionatura e dalle condizioni di lavorazione inclusi il tempo, la temperatura, l’umidità e il contenuto di sale (Escudero et al., 2013a). Recentemente, alcuni peptidi antiossidanti ed anti-ipertensivi sono stati purificati da prosciutti Spagnoli, di Parma, e da prosciutti Jinhua e Xuanwei, identificando sequenze rappresentative in ciascuno di essi (Escudero et al., 2013b, Xing et al., 2016; Zhu et al., 2017 ; Zuo et al., 2017). Durante il processo di stagionatura, le catepsine B, L e D svolgono un ruolo principale nel degradare le proteine miofibrillari aiutate da peptidil–peptidasi, aminopeptidasi e carbossipeptidasi nell’ulteriore rottura delle catene peptidiche con generazione di oligopeptidi e di amminoacidi liberi (Mora et al., 2011; Xing et al., 2018a). Un lungo periodo di maturazione indurrebbe un aumento della resa di peptidi e di amminoacidi, mentre la produzione di peptidi a catena più corta si concentrerebbero durante le fasi finali della stagionatura dei prosciutti (Zhang et al., 2009; Mora et al., 2011).
Identificazione dei peptidi bioattivi nelle proteine della carne
Grazie all’aumento delle conoscenze in bioinformatica, l’analisi predittiva in silico è diventata un nuovo metodo per prevedere ed identificare i peptidi bioattivi nelle varie proteine. Diversamente dai precedenti processi che prevedevano l’idrolisi e la purificazione in laboratorio, l’analisi predittiva in silico si basa principalmente sull’impiego di strumenti bioinformatici, come i database BIOPEP, ProtParam, Blast e PeptideCutter. Questo metodo ci aiuta a tracciare il rilascio di peptidi dalle proteine parentali e anche a predire la loro potenziale bioattività a seconda delle sequenze aminoacidiche (Dziuba e Dziuba, 2010; Lafarga & Hayes, 2014). Recentemente, l’analisi predittiva è stata impiegata per tracciare il rilascio di peptidi bioattivi da proteine di derivazione suina e bovina e viene considerata una base teorica per ulteriori verifiche sulla loro bioattività in esperimenti empirici (Lafarga et al., 2014; Sayd et al., 2016 ). Durante le analisi bioinformatiche condotte sulla carne di manzo, sono stati identificati 1743 peptidi insieme a 71 proteine nella carne sottoposta a cottura e si è visto che la digestione delle proteine veniva profondamente influenzata dalla temperatura di cottura (Sayd et al., 2016). Per quanto sappiamo dal processo di digestione gastrica, la proteina sarcoplasmatica risulterebbe più facilmente degradabile ad una temperatura più bassa (55° C), mentre sarebbe più difficile da degradare in condizioni di cottura che prevedono temperature più elevate (70° o 90° C) a causa della denaturazione indotta dal riscaldamento delle proteine. L’analisi in silico è uno strumento potente che fornisce molte informazioni utili per l’identificazione delle proteine e dei peptidi con la variabile della condizione di lavorazione del prodotto e ci fornisce un esempio prospettico per tracciare le sequenze dei peptidi bioattivi. Basandoci sull’analisi predittiva in silico, la frazione e il processo di purificazione vengono comunemente utilizzati per selezionare peptidi bioattivi nella miscela di idrolizzati proteici. Generalmente, i metodi di purificazione più diffusi includono l’ultrafiltrazione, la cromatografia a fase inversa, la cromatografia ad esclusione dimensionale, la cromatografia su gel di filtrazione, la cromatografia a scambio ionico e la cromatografia liquida ad elevate prestazioni. Tra questi, la cromatografia liquida ad elevate prestazioni a fase inversa (RP-HPLC) viene ampiamente utilizzata per la caratterizzazione dei peptidi bioattivi e potrebbe essere associata alla spettrometria di massa (MS) per separare le sequenze di peptidi in base al peso molecolare. Nell’industria, l’RP-HPLC è poco adottata poiché la capacità di separazione è ancora limitata ed il costo molto gravoso. Secondo lo studio di Korhonen & Pihlanto (2006), la combinazione dell’utilizzo di enzimi immobilizzati e di tecniche di separazione tramite membrana sembrerebbe più facile da attuare per produrre peptidi bioattivi su larga scala. Un importante vantaggio dell’impiego degli enzimi e delle tecniche di separazione con membrana risiede nel fatto che non vengono utilizzate sostanze chimiche tossiche e non si ha produzione di residui organici nella formazione finale del peptide.
Le funzioni dei peptidi derivati dalla carne
Peptidi anti-ipertensivi
L’enzima convertitore dell’angiotensina (ACE), una peptidasi trans-membrana, svolge molteplici funzioni negli organismi, tra cui la degradazione della bradichinina, il clivaggio di un potente vasodilatatore e la compartecipazione al sistema renina-angiotensina (Ahhmed e Muguruma, 2010). Partendo dalla forma inattiva angiotensina I, l’ACE la converte in un potente vasocostrittore, l’angiotensina II (Ang II), che rappresenta un fattore di rischio per l’aumento della pressione sanguigna. Pertanto, l’inibizione dell’attività dell’ACE sarebbe una terapia efficace per il trattamento dell’ipertensione clinica e delle malattie cardiovascolari (Iwaniak et al., 2014). Negli ultimi anni, lo studio dei peptidi anti-ipertensivi è diventato un argomento chiave nel campo degli studi condotti sul regno animale, marino e vegetale (Lee & Hur, 2017). Nella maggior parte degli studi, la potenza inibitoria dei peptidi anti-ipertensivi viene generalmente valutata mediante il valore IC50 e il modello animale per il controllo della pressione arteriosa. Per quanto riguarda le proteine derivate dalla carne, i peptidi ACE inibitori sono ampiamente studiati e una lista riassuntiva di tali peptidi è mostrata nella Tabella 1. Dopo idrolisi mediante termolisina (EC 3.4.24.27), Arihara et al. (2001) hanno identificato due peptidi ACE-inibitori con sequenza MNPPK e ITTNP nel muscolo di suino, e questo è stato il primo report condotto sui peptidi antipertensivi derivati dalla carne del suino. La somministrazione orale di idrolizzati suini e di sequenze sintetiche di MNPPK e di ITTNP è stata poi verificata in ratti spontaneamente ipertesi (SHR) nei quali, 210 e 2100 mg (idrolizzato kg–1 di peso corporeo) diminuivano significativamente la pressione arteriosa sistolica (SBP). Nel gruppo sottoposto al trattamento con MNPPK e ITTNP, c’erano sequenze idrolizzate identificate come MNP, NPP, PPK, ITT, TTN e TNP. Tutti i peptidi possedevano attività ACE-inibente, ed è stato dimostrato che il PPK aveva l’effetto antipertensivo maggiore sui test della SBP (Nakashima et al., 2002). Katayama et al. (2007) hanno isolato sequenze EKERERQ e KRQKYDI in idrolizzati (tramite pepsina) di troponina scheletrica suina con valori IC50 di, rispettivamente, 552.5 e 26.2 μM. Dopo 3 e 6 ore di somministrazione in ratti SHR, è stato dimostrato che l’attività temporaneamente antipertensiva di KRQKYDI riduceva la pressione diastolica con una dose di 10 mg kg –1. Analogamente, Muguruma et al. (2009) hanno purificato la sequenza KRVITY (valore IC50, 6.1 μM) nella miosina scheletrica suina idrolizzata mediante pepsina ed hanno notato una notevole attività antipertensiva dopo somministrazione orale ai SHR (10 mg kg–1). Oltre alla degradazione con un singolo enzima, alcuni peptidi ACE inibitori sono stati generati mediante digestione intestinale artificiale messa a punto con un mix di enzimi. Escudero et al. (2010) hanno identificato un idrolizzato derivato dalla carne suina dopo digestione con pepsina e pancreatina. Tra tutte le sequenze, quelle KAPVA e PTPVP mostravano notevoli effetti inibenti sull’ACE, con valori IC50 rispettivamente di 46.56 e 256.41 μM. Escudero et al. (2012) hanno scelto tre peptidi RPR, KAPVA e PTPVP per testare l’attività antipertensiva sui ratti SHR. Questi tre peptidi avevano un’influenza significativa sul controllo della pressione arteriosa nei ratti SHR dopo somministrazione orale. Secondo lo studio di Banerjee & Shanthi (2012), esistevano anche dei peptidi ACE-inibitori generati dall’idrolisi (mediante collagenasi batterica) del collagene del tendine di Achille bovino. Sono state identificate due regioni biologicamente attive, AKGANGAPGIAGAPGFPGARGPSGPQGPSGPP e PAGNPGADGQPGAKGANGAP aventi proprietà ACE-inibitorie competitive con valori IC50 di 51.10 e 79.85 μM, rispettivamente. Le proprietà ACE inibitorie potrebbero essere mantenute all’80% anche dopo digestione in vitro da parte di pepsina, tripsina e chimotripsina, ciò implica che una catena più lunga non andrebbe ad ostacolare la bioattività antiipertensiva. Negli idrolizzati di fegato suino sono stati identificati peptidi ACE-inibitori e la loro somministrazione orale in SHR, ad una dose di 1 g per ratto–1, aveva un ruolo significativo nel controllo della pressione arteriosa (Inoue et al., 2013). Recentemente, i peptidi ACE-inibitori sono stati frazionati e separati anche da prosciutti stagionati a secco (Escudero et al., 2010; Mora et al., 2016; Zuo et al., 2017); nei prosciutti Spagnoli la sequenza AAATP è risultata essere quella con maggiore bioattività, con valore IC50 pari a 100 μM (Escudero et al., 2012). Dopo la somministrazione orale di AAATP ai ratti SHR, l’SBP si è ridotta di 25.62 mmHg entro 8 ore (Escudero et al., 2013a). Inoltre, i peptidi ACE inibitori presenti nel prosciutto Spagnolo potrebbero essere resistenti al calore e alla digestione gastrointestinale (Escudero et al., 2014). Durante la valutazione del trasporto su monostrato cellulare Caco-2 si è riscontrato, sul lato basale, un aumento dell’attività di AAPLAP e KPVAAP che ha raggiunto il 70% dopo 60 minuti dall’inizio del trasporto cellulare (Gallego et al., 2016). In base all’attività della peptidasi di membrana, la maggior parte dei peptidi sono stati degradati in oligopeptidi tranne il KPVAAP che è stato assorbito con la catena peptidica intatta. Oltre al suino, anche il pollo e il manzo erano una buona fonte proteica di peptidi anti-ipertensivi. Iroyukifujita et al. (2000) hanno controllato il valore IC50 dell’idrolizzato di muscolo di pollo digerito con termolisina, ed hanno isolato sette peptidi ACE-inibitori con le sequenze LKA, LKP, LAP, IKW, FQKPKR, FKGRYYP e IVGRPRHQG con valori IC50 compresi tra 0.21 e 14 μM. KPLLCS, ELFTT e KPLL sono stati isolati dal petto del pollo Korat dopo digestione GI in vitro, con valori IC50 di, rispettivamente, 0.37, 6.35 e 11.98 μM (Sangsawad et al., 2017). Sebbene KPLLCS sia risultato essere l’ACE-inibitore più efficace, la degradazione risultava inevitabile nel monostrato cellulare Caco-2. Tra questi tre peptidi, solo KPLL potrebbe essere trasportato in forma intatta con la più alta permeabilità e con la massima attività ACE-inibitoria anche dopo che è stato parzialmente degradato a KP e LL (Sangsawad et al., 2018). Jang et al. (2004) hanno estratto VLAQYK (valore IC50, 32.06 μM) da idrolizzati di muscolo di manzo e la somministrazione orale in ratti SHR ha mostrato una significativa diminuzione della SBP (Jang & Lee, 2005). Sebbene i peptidi possedessero un’accettabile capacità inibitoria in vitro, la somministrazione orale all’animale non avrebbe generato un altrettanto ragionevole effetto sulla pressione sanguigna (Iroyukifujita et al., 2000; Escudero et al., 2013a). Le peptidasi intra- o extracellulari presenti nel tratto gastroenterico e nel siero di sangue sono il primo schermo protettivo contro l’assorbimento dei peptidi, e questo creerebbe un grande ostacolo alla disponibilità dei peptidi bioattivi in vivo (Iwaniak et al., 2014). Oltre che come regolatore della pressione sanguigna, Ang II viene studiato anche perché in grado di stimolare la cascata infiammatoria così come l’aterosclerosi infiammatoria vascolare (Dandona et al., 2007). Nella ricerca di Lin et al. (2017), il peptide derivato dalla soia Leu-Ser-Trp ha mostrato di possedere un effetto anti-infiammatorio ed antiossidante, esplicato attraverso l’azione di AT1R così come attraverso il coinvolgimento di chinasi della famiglia Src e di chinasi ERK1/2. Per quanto riguarda i peptidi bioattivi derivati dalla carne, pochi studi si sono concentrati sull’interconnessione tra l’attività dell’ACE e la risposta antinfiammatoria così come sul coinvolgimento delle vie di segnalazione cellulare che quindi dovrebbero essere ulteriormente approfondite unitamente ai meccanismi dei peptidi bioattivi sull’attività di ACE.
Tabella 1. I peptidi ACE inibitori isolati dal muscolo e dai sottoprodotti della carne
Peptidi antiossidanti
Sebbene il meccanismo dell’attività antiossidante dei peptidi bioattivi non sia stato ancora precisato a sufficienza, il metodo più accettato di verificare le proprietà antiossidanti si basa sulla donazione di un atomo di idrogeno ad un radicale libero così come sull’attività chelante dei metalli utile a prevenire o eliminare l’eccesso di radicali liberi. Seguendo il meccanismo riportato sopra, nelle proteine derivate dalla carne è stato identificato un buon numero di peptidi antiossidanti. Tra questi, la β-alanil-L-istidina (carnosina) e la N-β-alanil-1-metil-L-istidina (anserina) sono i peptidi più noti (Nagasawa et al., 2001; Sarmadi & Ismail, 2010). In linea generale, la carnosina è abbondante nel muscolo degli animali e il suo contenuto viene influenzato anche dalla razza, dall’età, dall’attività riproduttiva e dal genere (Intarapichet e Maikhunthod, 2005). Un maggior contenuto di carnosina si ritrova in muscoli glicolitici come il bicipite femorale, il semimembranoso, il lunghissimo del dorso e il grande gluteo (Mora, Sentandreu e Toldr a, 2008). Nel muscolo di pollo, era maggiore il contenuto di anserina e l’attività antiossidante era attribuita principalmente alle capacità chelanti di alcuni metalli come lo zinco, il cobalto e il rame (Arihara, 2006; Young et al., 2013). Basandoci sulla sua attività di scavenging nei confronti dei radicali perossidi e superossidi e sulla prevenzione della formazione di carbonilazione e glicosilazione delle proteine, l’attività antiossidante della carnosina è stata ampiamente dimostrata (Preedy, 2015). Oltre ai dipeptidi citati sopra, nelle proteine derivate dalla carne vi è una grande quantità di peptidi antiossidanti purificati ed identificati, come mostrato nella Tabella 2. Dalle proteine miofibrillari, dopo trattamento con papaina ed actinase, sono stati purificati DSGVT, IEAEGE, DAQEKLE, EELDNALN e VPSIDDQEELM; DAQEKLE possedeva la massima attività antiossidante nei test in vitro (Saiga et al., 2003). Arihara (2006) ha purificato tre peptidi antiossidanti (con sequenze ALTA, SLTA e VT) anche nell’idrolizzato di actomiosina della carne di maiale, dopo trattamento con papaina. Nello studio di Wu et al. (2005), HVTEE e PVPVEGV sono stati isolati dall’estratto di carne di pollo, ed avevano l’eccellente capacità di prevenire l’auto-ossidazione dell’acido linoleico. Nel prosciutto di maiale idrolizzato con pepsina, i peptidi antiossidanti sono stati analizzati mediante elettroforesi su gel di poliacrilamide, effettuando un’indagine sul potere riducente dell’idrolizzato (Park & Chin, 2011). Dopo il trattamento con pepsina, le proteine del prosciutto sono state degradate in piccole frazioni con peso molecolare inferiore ai 7 kDa. Inoltre, l’idrolizzato proteico allo 0.5% ha mostrato anche una notevole capacità di inibizione del processo di ossidazione dell’acido linoleico. Nei muscoli della punta di petto di bovino, Di Bernardini et al. (2012) hanno studiato l’antiossidante dell’idrolisi proteica mediante saggio 2.2-difenil-1-picrilidrazile (DPPH), saggio FRAP (Ferric Reducing Antioxidant Power) e mediante il test di chelazione degli ioni metallici; la frazione ottenuta è stata ultrafiltrata attraverso un filtro a membrana molecolare (3-, 10-kDa) e sono stati identificati 9 peptidi nella frazione da 3 kDa e 15 peptidi nella frazione da 10 kDa. MQIFVKTLTG e DLSDGEQGVL erano due frammenti ottenuti da idrolizzati di proteine di cervo (Kim et al., 2009). La loro attività di scavenging è stata testata con DPPH, sul radicale ossidrile, perossido e superossido con i valori IC50 di 77, 44, 85 e 217 μg mL–1, e questo è stato il primo report che riportava le potenti capacità antiossidanti degli idrolizzati enzimatici ottenuti dalle proteine di cervo. Oltre alle proteine muscolari, anche i sottoprodotti della carne, compresi il collagene della pelle e le proteine del sangue, vengono ampiamente studiati per poter ricavare peptidi bioattivi. L’idrolisi del collagene presente nella pelle suina con cocktail di proteasi, ha promosso il rilascio di peptidi (QGAR, LQGM, LQGMH e HC) con una forte capacità antiossidante e si è visto che QGAR aveva la miglior capacità di donare protoni (Li et al., 2007). Nelle proteine contenute nelle corna di bufalo d’acqua, sono stati individuati tre peptidi antiossidanti: QYDQGV, YEDCTDCGN e AADNANELFPPN (Liu et al., 2010). Basandosi sul saggio DPPH e sul test del rilascio di lattico deidrogenasi nelle cellule cerebrali di ratto, questi tre peptidi antiossidanti hanno giocato un ruolo protettivo nella comparsa di lesioni indotte da H2O2 (Liu et al., 2010). Senza l’idrolisi in vitro, il peptide presente nel prosciutto stagionato a secco viene solitamente estratto direttamente mediante scioglimento nella soluzione tampone e quindi separato mediante cromatografia su gel (Liu et al., 2016). Ad oggi, nel prosciutto crudo Spagnolo sono stati isolati 28 peptidi antiossidanti (Escudero et al., 2012; Gallego, et al., 2018); tra tutti questi le sequenze SAGNPN e GLAGA avevano il più alto potere riducente e la massima attività di scavenger dei radicali liberi (Escudero et al., 2013a, 2013b). Nei prosciutti Jinhua e Xuanwei, c’erano abbondanti peptidi che si generavano nella fase finale della stagionatura e la maggior parte dei peptidi bioattivi erano <1600 Da (Zhu et al., 2017; Xing et al., 2018a). Come determinato dal saggio dei radicali liberi e della chelazione del metallo, GKFNV e DLEE erano i peptidi bioattivi maggiormente presenti nel prosciutto Jinhua e Xuanwei, rispettivamente (Zhu et al., 2013; Xing et al., 2016). AEEEYPDL e SNAAC, purificati nel prosciutto crudo Spagnolo stagionato, mostravano una straordinaria capacità antiossidante, e i test ORAC e ABTS hanno evidenziato una buona resistenza al calore e alla salagione. Tuttavia, la digestione GI in vitro potrebbe ridurre la bioattività di AEEEYPDL e SNAAC (Gallego et al., 2018a, 2018b). Per il DLEE presente nel prosciutto Xuanwei, è stata dimostrata una buona stabilità senza generazione di alcun oligopeptide durante la digestione GI in vitro. Inoltre, l’indagine sulla stabilità e sul trasporto effettuata con monostrati cellulari Caco-2 lasciava intendere che il DLEE potesse mantenere l’attività antiossidante nel monostrato cellulare, mentre il trasporto paracellulare indotto da occludina sarebbe la via principale per l’assorbimento (Xing et al., 2018b).
Tabella 2. Peptidi antiossidanti isolati dal muscolo e dai sottoprodotti della carne
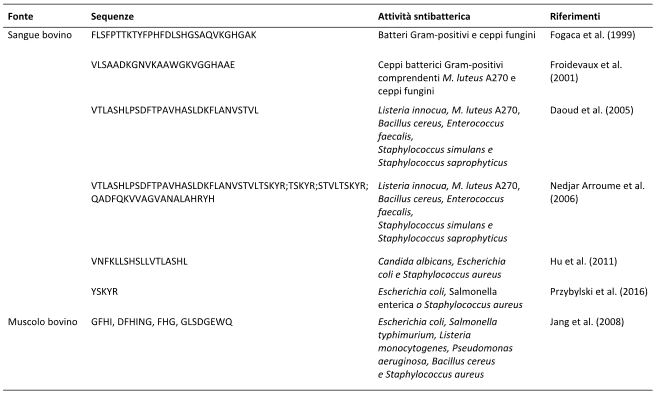
Peptidi antibatterici
Secondo gli studi di Zasloff (2002) e di Lee et al. (2011), i peptidi antibatterici hanno un ampio spettro di proprietà nell’inibire alcuni microrganismi inclusi batteri, funghi e virus. Per quanto riguarda le proteine derivate dalla carne, il peptide antimicrobico è stato per lo più identificato nelle emoglobine, come mostrato nella Tabella 3. Fogac a et al. (1999) sono stati i primi a purificare la sequenza FLSFPTTKTYFPHFLSHGSAQVKGHGAK dall’emoglobina bovina e questo peptide ha mostrato un’eccellente attività inibitoria sui batteri Gram-positivi e su ceppi di Funghi. Anche VTLASHLPSDFTPAVHASLDKFLANVSTVL è stato separato dall’emoglobina bovina ed ha mostrato una notevole attività antibatterica contro Listeria innocua, M. luteus A270, Bacillus cereus, Enterococcus faecalis, Staphylococcus simulans e Staphylococcus saprophyticus (Daoud et al., 2005). Recentemente è stato purificato dalla parte centrale dell’α-emoglobina bovina VNFKLLSHSLLVTLASHL, che ha mostrato una notevole attività antibatterica su Escherichia coli, Candida albicans e Staphylococcus aureus (Hu et al., 2011). Negli studi precedenti, i peptidi antibatterici avevano per lo più costituiti conformazioni alfa-elica lineari e a foglietto beta, che contribuivano in modo essenziale all’azione nei confronti dei microrganismi sensibili (Powers & Hancock, 2003). Tuttavia, viste le loro proprietà antibatteriche, sono stati studiati anche peptidi più piccoli come KYR e SKYR presenti nella catena α dell’emoglobina (Catiau et al., 2011). Oltre a queste due sequenze, Catiau et al. (2011) hanno anche testato una serie di peptidi derivati dall’emoglobina α 107-141. È interessante notare che tutti i peptidi con sequenze KYR avevano un effetto antimicrobico. La presenza di tirosina (Y) era eccezionalmente elevata in essi, ciò implicava che la corta sequenza antimicrobica KYR potesse essere il bersaglio per l’interazione tra il peptide e il batterio. Oltre all’emoglobina ematica bovina, anche proteine sarcoplasmatiche di manzo contenevano peptidi antimicrobici con sequenze GFHI, DFHING, FHG e GLSDGEWQ che, tra le altre cose, possedevano anche valide proprietà antipertensive (Jang et al., 2008). L’attività antimicrobica di ciascun peptide è stata controllata su E. coli, Salmonella typhimurium, Listeria monocytogenes, Pseudomonas aeruginosa, B. cereus e S. aureus (Jang et al., 2008). Recentemente, il peptide antimicrobico YSKYR proveniente dall’emoglobina, è stato aggiunto in prodotti a base di carne ad una concentrazione dello 0.5% (w/w), mostrando un effetto antibatterico sulla proliferazione dei microrganismi durante la conservazione a 4°C. L’inibizione della crescita dei coliformi era approssimativamente simile a quella esercitata dall’idrossitoluene butilato (BHT). I risultati hanno stabilito che i peptidi antimicrobici (presenti nell’emoglobina α137-141) potevano essere considerati potenzialmente come dei conservanti impiegabili nella carne e nei suoi derivati (Przybylski et al., 2016). Se parliamo di effetto antibatterico, l’interazione tra i peptidi e la membrana batterica gioca un ruolo sicuramente primario. Questo passaggio è favorito dalla formazione di interazioni elettrostatiche tra la catena laterale del peptide (che ha carica positiva) e la membrana batterica che invece è carica negativamente (Lafarga & Hayes, 2014). In linea generale l’interazione elettrostatica potrebbe formarsi sulla superficie di tutti i batteri Gram-negativi o Gram-positivi, senza l’intervento di alcun recettore (Bechinger & Lohner, 2006). Per quanto riguarda l’interazione tra peptidi antibatterici e membrana batterica, si ha un attacco crociato costituito da varie fasi che prevedono la disgregazione della membrana, la formazione di canali transmembrana, la traslocazione e la solubilizzazione della membrana, tutte cose che promuovono la penetrazione della molecola del peptide nello spazio intracellulare e quindi l’alterazione del metabolismo batterico (Santos et al., 2018). Dopo aver attraversato la membrana batterica, i peptidi antibatterici verrebbero coinvolti anche in processi intracellulari come la sintesi proteica, la trascrizione del DNA o l’attività enzimatica, cosa che inoltre va di pari passo con la permeabilizzazione della membrana che si ha durante l’attività extracellulare (Scocchi et al., 2016). Quindi, in linea generale, le proprietà antibatteriche dei peptidi bioattivi sarebbero date dall’effetto sinergico che si ha tra l’interazione extracellulare e l’azione intracellulare.
Tabella 3. Peptidi antibatterici isolati dal muscolo e dai sottoprodotti della carne
Altre attività funzionali
Come le fonti naturali di proteine, i peptidi bioattivi derivati dalla carne avrebbero dimostrato di possedere anche proprietà antitrombotiche, oppioide-simili, di inibizione della proliferazione cellulare e di tossicità per le cellule cancerose e di inibizione dell’endopeptidasi (PEP, EC 3.4.21.26). Shimizu et al. (2009) hanno purificato il muscolo lunghissimo del dorso di suini sottoponendolo a trattamento con papaina e quindi hanno testato l’attività antitrombotica dei peptidi ottenuti in un modello murino (trombosi dell’arteria carotidea tramite induzione Elio-Neon). Dopo somministrazione orale di 70 mg/kg-1 di peso corporeo, i peptidi purificati favorivano l’inibizione della comparsa di trombosi che era equivalente a quella generata dall’aspirina. Nello studio di Jang et al. (2008), GFHI è stato analizzato poiché aveva un significativo effetto citotossico sulla proliferazione delle cellule del cancro al seno e diminuiva la sopravvivenza delle cellule gastriche. Durante gli ultimi decenni, un certo numero di peptidi oppioidi, come LVVYPWT, LVVYPWTQRF e LVVYPWTQR, è stato ottenuto da LVV-Hemorphin-4,6,7. Questi tre peptidi oppioidi possiedono lo stesso YPWT (con struttura relativamente stabile nella loro sequenza) che potrebbe essere alla base della capacità di espletare la loro bioattività, andando a legarsi ai recettori oppioidi presenti nel sistema cardiovascolare e nel cervello (Collinder et al., 2005).
Conclusione
Secondo i test biochimici, si è visto che i peptidi rilasciati dalle proteine della carne possiedono un’ampia varietà di attività fisiologiche funzionando come antiossidanti, antipertensivi e antitrombotici. Le proprietà benefiche di questi peptidi potrebbero promuovere l’assunzione giornaliera di proteine derivate dalla carne. Ad oggi, sono stati identificati molti dei peptidi bioattivi presenti nelle proteine derivate dalla carne, ma la maggior parte delle loro funzioni è stata valutata solamente in vitro, il che non ci aiuta a spiegare in maniera esaustiva gli eventuali effetti bioattivi che potrebbero avere dopo la digestione e l’assorbimento all’intero del corpo umano. Inoltre, sono in corso di valutazione anche la biodisponibilità, la bioaccessibilità, il profilo di sicurezza e la dose-risposta in vivo, per fornire ulteriori chiarimenti sulle proprietà benefiche dei peptidi derivati dalla carne. Sebbene sul mercato siano già stati lanciati alcuni prodotti contenenti peptidi bioattivi derivati principalmente da latte e da organismi marini, c’è ancora molta strada da fare per arrivare a produrre peptidi derivati dalla carne. Le proteine che provengono dalla carne sono molto più costose rispetto a quelle di origine vegetale, per questo sembrerebbe essere un’opzione interessante l’impiego di sottoprodotti della carne che soddisferebbe anche ulteriori requisiti come il risparmio energetico e la salvaguardia dell’ambiente. Inoltre, la mancanza di tecniche di selezione e di purificazione su larga scala è la sfida che attualmente accompagna la produzione a costo contenuto dei peptidi bioattivi. Prima dell’immissione in commercio dei peptidi bioattivi, va tenuto in considerazione anche l’aspetto normativo che prevede la suddivisione tra componenti funzionali ed alimenti, la tracciabilità dell’efficacia sulla salute, la protezione dei consumatori dai rischi che possono venire da alimenti speciali e la standardizzazione delle componenti bioattive. Pertanto, un’ulteriore verifica della bioattività in vivo, la messa a punto di un efficace processo produttivo e di una buona normativa sono i principali aspetti verso cui deve proiettarsi la ricerca, ancor prima dell’immissione in commercio dei peptidi bioattivi.
Ringraziamenti
Questa ricerca è supportata dal National Key R&D Program of China (2016YFD0400700, 2016YFD0400703) e dallo State Key Research and Development Plan “Modern Food Processing and Food Storage and Transportation Technology and Equipment” (2018YFD0400101).
Bibliografia
Ahhmed, A.M. & Muguruma, M. (2010). A review of meat protein hydrolysates and hypertension. Meat Science, 86, 110–118.
Arihara, K. (2006). Functional properties of bioactive peptides derived from meat proteins. In: Advanced Technologies for Meat Processing (edited by F. Toldra). Pp. 245–274. New York, NY: Springer.
Arihara, K., Nakashima, Y., Mukai, T., Ishikawa, S. & Itoh, M. (2001). Peptide inhibitors for angiotensin I-converting enzyme from enzymatic hydrolysates of porcine skeletal muscle proteins. Meat Science, 57, 319–324.
Banerjee, P. & Shanthi, C. (2012). Isolation of novel bioactive regions from bovine Achilles tendon collagen having angiotensin Iconverting enzyme-inhibitory properties. Process Biochemistry, 47,2335–2346.
Bauchart, C., R_emond, D., Chambon, C. et al. (2006). Small peptides (<5 kDa) found in ready-to-eat beef meat. Meat Science, 74, 658–666.
Bechinger, B. & Lohner, K. (2006). Detergent-like actions of linear amphipathic cationic antimicrobial peptides. Biochimica et Biophysica Acta (BBA)-Biomembranes, 1758, 1529–1539.
Byun, H.-G., Lee, J.K., Park, H.G., Jeon, J.-K. & Kim, S.-K. (2009). Antioxidant peptides isolated from the marine rotifer, Brachionus rotundiformis. Process Biochemistry, 44, 842–846.
Catiau, L., Traisnel, J., Delval-Dubois, V., Chihib, N.-E., Guillochon, D. & Nedjar-Arroume, N. (2011). Minimal antimicrobial peptidic sequence from hemoglobin alpha-chain: KYR. Peptides, 32, 633–638.
Collinder, E., Nyberg, F., Sanderson-Nydahl, K., Gottlieb-Vedi, M. & Lindholm, A. (2005). The opioid haemorphin-7 in horses during low-speed and high-speed treadmill exercise to fatigue. Journal of Veterinary Medicine Series A, 52, 162–165.
Dandona, P., Dhindsa, S., Ghanim, H. & Chaudhuri, A. (2007). Angiotensin II and inflammation: the effect of angiotensin-converting enzyme inhibition and angiotensin II receptor blockade. Journal of Human Hypertension, 21, 20.
Daoud, R., Dubois, V., Bors-Dodita, L. et al. (2005). New antibacterial peptide derived from bovine hemoglobin. Peptides, 26, 713–719.
Di Bernardini, R., Mullen, A.M., Bolton, D., Kerry, J., O’Neill, E. & Hayes, M. (2012). Assessment of the angiotensin-I-converting enzyme (ACE-I) inhibitory and antioxidant activities of hydrolysates of bovine brisket sarcoplasmic proteins produced by papain and characterisation of associated bioactive peptidic fractions. Meat Science, 90, 226–235.
Dziuba, M. & Dziuba, B. (2010). In silico analysis of bioactive peptides. In: Bioactive Proteins and Peptides as Functional Foods and Nutraceuticals (edited by Y. Mine, E. Li-Chan & B. Jiang). Pp. 325–340. Ames, IA: Wiley-Blackwell.
Escudero, E., Sentandreu, M.A., Arihara, K. & Toldra, F. (2010). Angiotensin I-converting enzyme inhibitory peptides generated from in vitro gastrointestinal digestion of pork meat. Journal of Agricultural and Food Chemistry, 58, 2895–2901.
Escudero, E., Toldr_a, F., Sentandreu, M.A., Nishimura, H. & Arihara, K. (2012). Antihypertensive activity of peptides identified in the in vitro gastrointestinal digest of pork meat. Meat Science, 91, 382–384.
Escudero, E., Mora, L., Fraser, P.D., Aristoy, M.-C., Arihara, K. & Toldr_a, F. (2013a). Purification and identification of antihypertensive peptides in Spanish dry-cured ham. Journal of Proteomics, 78, 499–507.
Escudero, E., Mora, L., Fraser, P.D., Aristoy, M.-C. & Toldr_a, F. (2013b). Identification of novel antioxidant peptides generated in Spanish dry-cured ham. Food Chemistry, 138, 1282–1288.
Escudero, E., Mora, L. & Toldr_a, F. (2014). Stability of ACE inhibitory ham peptides against heat treatment and in vitro digestion. Food Chemistry, 161, 305–311.
Fogac_a, A.C., da Silva, P.I., Miranda, M.T.M. et al. (1999). Antimicrobial activity of a bovine hemoglobin fragment in the tick Boophilus microplus. Journal of Biological Chemistry, 274, 25330–25334.
Froidevaux, R., Krier, F., Nedjar-Arroume, N., et al. (2001). Antibacterial activity of a pepsin-derived bovine hemoglobin fragment. Febs Letters, 491, 159–163.
Fulop, T., Tessier, D. & Carpentier, A. (2006). The metabolic syndrome. Pathologie Biologie, 54, 375–386.
Gallego, M., Grootaert, C., Mora, L., Aristoy, M.C., Van Camp, J. & Toldr_a, F. (2016). Transepithelial transport of dry-cured ham peptides with ACE inhibitory activity through a Caco-2 cell monolayer. Journal of Functional Foods, 21, 388–395.
Gallego, M., Mora, L., Reig, M. & Toldr_a, F. (2018a). Stability of the potent antioxidant peptide SNAAC identified from Spanish dry-cured ham. Food Research International, 105, 873–879.
Gallego, M., Mora, L. & Toldr_a, F. (2018b). Characterisation of the antioxidant peptide AEEEYPDL and its quantification in Spanish dry-cured ham. Food Chemistry, 258, 8–15.
Hu, J., Xu, M., Hang, B. et al. (2011). Isolation and characterization of an antimicrobial peptide from bovine hemoglobin a-subunit. World Journal of Microbiology and Biotechnology, 27, 767–771.
Hu, Y.Y., Xing, L.J., Zhou, G.H. & Zhang, W.G. (2016). Antioxidant activity of crude peptides extracted from dry-cured Jinhua ham. Journal of Food and Nutrition Research, 4, 377–387.
Huff-Lonergan, E., Zhang, W.G. & Lonergan, S.M. (2010). Biochemistry of postmortem muscle – lessons on mechanisms of meat tenderization. Meat Science, 86, 184–195.
Inoue, N., Hamasaki, A., Hidaka, S. et al. (2013). Analysis of the components of porcine liver hydrolysate and examination of the antioxidant activity and angiotensin converting enzyme (ACE)-inhibiting activity. Yakugaku Zasshi: Journal of the Pharmaceutical Society of Japan, 133, 107–115.
Intarapichet, K.-O. & Maikhunthod, B. (2005). Genotype and gender differences in carnosine extracts and antioxidant activities of chicken breast and thigh meats. Meat Science, 71, 634–642.
Iroyukifujita, H., Eiichiyokoyama, K. & Yoshikawa, M. (2000). Classification and antihypertensive activity of angiotensin I-converting enzyme inhibitory peptides derived from food proteins. Journal of Food Science, 65, 564–569.
Iwaniak, A., Minkiewicz, P. & Darewicz, M. (2014). Food-originating ACE inhibitors, including antihypertensive peptides, as preventive food components in blood pressure reduction. Comprehensive Reviews in Food Science and Food Safety, 13, 114–134.
Jang, A. & Lee, M. (2005). Purification and identification of angiotensin converting enzyme inhibitory peptides from beef hydrolysates. Meat Science, 69, 653–661.
Jang, A., Cho, Y., Lee, J., Shin, J., Kim, I. & Lee, M. (2004). The effect of beef peptide on blood pressure and serum lipid concentration of spontaneously hypertensive rat (SHR). Journal of Animal Science and Technology, 46, 107–114.
Jang, A., Jo, C., Kang, K.-S. & Lee, M. (2008). Antimicrobial and human cancer cell cytotoxic effect of synthetic angiotensin-converting enzyme (ACE) inhibitory peptides. Food Chemistry, 107, 327–336.
Je, J.-Y., Park, P.-J. & Kim, S.-K. (2005). Antioxidant activity of a peptide isolated from Alaska pollack (Theragra chalcogramma) frame protein hydrolysate. Food Research International, 38, 45–50.
Katayama, K., Anggraeni, H.E., Mori, T. et al. (2007). Porcine skeletal muscle troponin is a good source of peptides with angiotensin-I converting enzyme inhibitory activity and antihypertensive effects in spontaneously hypertensive rats. Journal of Agricultural and Food Chemistry, 56, 355–360.
Kim, S.-K., Kim, Y.-T., Byun, H.-G., Park, P.-J. & Ito, H. (2001). Purification and characterization of antioxidative peptides from bovine skin. BMB Reports, 34, 219–224.
Kim, E.-K., Lee, S.-J., Jeon, B.-T. et al. (2009). Purification and characterisation of antioxidative peptides from enzymatic hydrolysates of venison protein. Food Chemistry, 114, 1365–1370.
Korhonen, H. & Pihlanto, A. (2006). Bioactive peptides: production and functionality. International Dairy Journal, 16, 945–960.
Lafarga, T. & Hayes, M. (2014). Bioactive peptides from meat muscle and by-products: generation, functionality and application as functional ingredients. Meat Science, 98, 227–239.
Lafarga, T., O’Connor, P. & Hayes, M. (2014). Identification of novel dipeptidyl peptidase-IV and angiotensin-I-converting enzyme inhibitory peptides from meat proteins using in silico analysis. Peptides, 59, 53–62.
Lee, S.Y. & Hur, S.J. (2017). Antihypertensive peptides from animal products, marine organisms, and plants. Food Chemistry, 228, 506–517.
Lee, S.-J., Kim, E.-K., Hwang, J.-W. et al. (2010). Purification and characterisation of an antioxidative peptide from enzymatic hydrolysates of duck processing by-products. Food Chemistry, 123, 216–220.
Lee, S.-H., Kim, S.-J., Lee, Y.-S., Song, M.-D., Kim, I.-H. & Won, H.-S. (2011). De novo generation of short antimicrobial peptides with simple amino acid composition. Regulatory Peptides, 166, 36–41.
Lee, S.-J., Kim, Y.-S., Hwang, J.-W. et al. (2012). Purification and characterization of a novel antioxidative peptide from duck skin by-products that protects liver against oxidative damage. Food Research International, 49, 285–295.
Leygonie, C., Britz, T.J. & Hoffman, L.C. (2012). Impact of freezing and thawing on the quality of meat. Meat Science, 91, 93–98.
Li, Y. & Yu, J. (2015). Research progress in structure-activity relationship of bioactive peptides. Journal of Medicinal Food, 18, 147–156.
Li, B., Chen, F., Wang, X., Ji, B. & Wu, Y. (2007). Isolation and identification of antioxidative peptides from porcine collagen hydrolysate by consecutive chromatography and electrospray ionization– mass spectrometry. Food Chemistry, 102, 1135–1143.
Lin, Q., Liao, W., Bai, J., Wu, W. & Wu, J. (2017). Soy proteinderived ACE-inhibitory peptide LSW (Leu-Ser-Trp) shows antiinflammatory activity on vascular smooth muscle cells. Journal of Functional Foods, 34, 248–253.
Liu, R., Wang, M., Duan, J.-A., Guo, J.-M. & Tang, Y.-P. (2010). Purification and identification of three novel antioxidant peptides from Cornu bubali (water buffalo horn). Peptides, 31, 786–793.
Liu, R., Xing, L., Fu, Q., Zhou, G.-H. & Zhang, W.-G. (2016). A review of antioxidant peptides derived from meat muscle and byproducts. Antioxidants, 5, 32–47.
Mirdhayati, I., Hermanianto, J., Wijaya, C.H., Sajuthi, D. & Arihara, K. (2016). Angiotensin converting enzyme (ACE) inhibitory and antihypertensive activities of protein hydrolysate from meat of Kacang goat (Capra aegagrus hircus). Journal of the Science of Food and Agriculture, 96, 3536–3542.
Mora, L., Sentandreu, M._ A. & Toldr_a, F. (2008). Contents of creatine, creatinine and carnosine in porcine muscles of different metabolic types. Meat Science, 7, 709–715.
Mora, L., Valero, M., Del Pino, M.S., Sentandreu, M. & Toldr_a, F. (2011). Small peptides released from muscle glycolytic enzymes during dry-cured ham processing. Journal of Proteomics, 74, 442–450.
Mora, L., Reig, M. & Toldr_a, F. (2014). Bioactive peptides generated from meat industry by-products. Food Research International, 65, 344–349.
Mora, L., Escudero, E. & Toldr_a, F. (2016). Characterization of the peptide profile in Spanish Teruel, Italian Parma and Belgian drycured hams and its potential bioactivity. Food Research International, 89, 638–646.
Muguruma, M., Ahhmed, A.M., Katayama, K., Kawahara, S., Maruyama, M. & Nakamura, T. (2009). Identification of pro-drug type ACE inhibitory peptide sourced from porcine myosin B: evaluation of its antihypertensive effects in vivo. Food Chemistry, 114, 516–522.
Nagasawa, T., Yonekura, T., Nishizawa, N. & Kitts, D.D. (2001). In vitro and in vivo inhibition of muscle lipid and protein oxidation by carnosine. Molecular and Cellular Biochemistry, 225, 29–34.
Nakashima, Y., Arihara, K., Sasaki, A., Mio, H., Ishikawa, S. & Itoh, M. (2002). Antihypertensive activities of peptides derived from porcine skeletal muscle myosin in spontaneously hypertensive rats. Journal of Food Science, 67, 434–437.
Nedjar-Arroume, N., Dubois-Delval, V., Miloudi, K., et al. (2006). Isolation and characterization of four antibacterial peptides from bovine hemoglobin. Peptides, 27, 2082–2089.
Ohata, M., Uchida, S., Zhou, L. & Arihara, K. (2016). Antioxidant activity of fermented meat sauce and isolation of an associated antioxidant peptide. Food Chemistry, 194, 1034–1039.
Organization, W. H. (2011). Global tuberculosis control: WHO report 2011.
Park, S.Y. & Chin, K.B. (2011). Antioxidant activities of pepsin hydrolysates of water-and salt-soluble protein extracted from pork hams. International Journal of Food Science & Technology, 46, 229–235.
Park, E.Y., Morimae, M., Matsumura, Y., Nakamura, Y. & Sato, K. (2008). Antioxidant activity of some protein hydrolysates and their fractions with different isoelectric points. Journal of Agricultural and Food Chemistry, 56, 9246–9251.
Powers, J.-P.S. & Hancock, R.E. (2003). The relationship between peptide structure and antibacterial activity. Peptides, 24, 1681–1691.
Preedy, V. (2015). Imidazole dipeptides: Chemistry, analysis, function and effects. Royal Society of Chemistry. Pp. 217–237. Royal Society of Chemistry: United Kingdom.
Przybylski, R., Firdaous, L., Ch^ataign_e, G., Dhulster, P. & Nedjar, N. (2016). Production of an antimicrobial peptide derived from slaughterhouse by-product and its potential application on meat as preservative. Food Chemistry, 211, 306–313.
Sadat, L., Cakir-Kiefer, C., N’Negue, M.-A., Gaillard, J.-L., Girardet, J.-M. & Miclo, L. (2011). Isolation and identification of antioxidative peptides from bovine a-lactalbumin. International Dairy Journal, 21, 214–221.
Saiga, A., Tanabe, S. & Nishimura, T. (2003). Antioxidant activity of peptides obtained from porcine myofibrillar proteins by protease treatment. Journal of Agricultural and Food Chemistry, 51, 3661–3667.
Sangsawad, P., Roytrakul, S. & Yongsawatdigul, J. (2017). Angiotensin converting enzyme (ACE) inhibitory peptides derived from the simulated in vitro gastrointestinal digestion of cooked chicken breast. Journal of Functional Foods, 29, 77–83.
Sangsawad, P., Choowongkomon, K., Kitts, D.D., Chen, X.-M., Li- Chan, E.C. & Yongsawatdigul, J. (2018). Transepithelial tran sport and structural changes of chicken angiotensin I-converting enzyme (ACE) inhibitory peptides through Caco-2 cell monolayers. Journal of Functional Foods, 45, 401–408.
Santos, J.C., Sousa, R.C., Otoni, C.G. et al. (2018). Nisin and other antimicrobial peptides: production, mechanisms of action, and application in active food packaging. Innovative Food Science & Emerging Technologies, 48, 179–194.
Sarmadi, B.H. & Ismail, A. (2010). Antioxidative peptides from food proteins: a review. Peptides, 31, 1949–1956.
Sayd, T., Chambon, C. & Sant_e-Lhoutellier, V. (2016). Quantification of peptides released during in vitro digestion of cooked meat. Food Chemistry, 197, 1311–1323.
Scocchi, M., Mardirossian, M., Runti, G. & Benincasa, M. (2016). Non-membrane permeabilizing modes of action of antimicrobial peptides on bacteria. Current Topics in Medicinal Chemistry, 16, 76–88.
Shimizu, M., Sawashita, N., Morimatsu, F. et al. (2009). Antithrombotic papain-hydrolyzed peptides isolated from pork meat. Thrombosis Research, 123, 753–757.
Wang, L.-S., Huang, J.-C., Chen, Y.-L., Huang, M. & Zhou, G.-H. (2015). Identification and characterization of antioxidant peptides from enzymatic hydrolysates of duck meat. Journal of Agricultural and Food Chemistry, 63, 3437–3444.
Wu, H.-C., Pan, B.S., Chang, C.-L. & Shiau, C.-Y. (2005). Lowmolecular- weight peptides as related to antioxidant properties of chicken essence. Journal of Food and Drug Analysis, 13, 176–183.
Xing, L.-J., Hu, Y.-Y., Hu, H.-Y., Ge, Q.-F., Zhou, G.-H. & Zhang, W.-G. (2016). Purification and identification of antioxidative peptides from dry-cured Xuanwei ham. Food Chemistry, 194, 951–958.
Xing, L., Liu, R., Gao, X. et al. (2018a). The proteomics homology of antioxidant peptides extracted from dry-cured Xuanwei and Jinhua ham. Food Chemistry, 266, 420–426.
Xing, L., Liu, R., Tang, C., Pereira, J., Zhou, G. & Zhang, W. (2018b). The antioxidant activity and transcellular pathway of Asp-Leu-Glu-Glu in a Caco-2 cell monolayer. International Journal of Food Science and Technology, 53, 2405–2414.
Xiong, Y.L. (2018). Proteins in Food Processing, 2nd edn, Muscle protein. Pp. 127–148. Woodhead Publishing Series in Food Science, Technology and Nutrition: Sawston, Cambridge.
Yanfeng, D.X.Z.W.C. & Li, N. (2006). Study on enzymolysis conditions of chicken-mashed bone by flavourzyme. Journal of Chinese Institute of Food Science and Technology, 1, 024.
Young, K.M., Cramp, R.L. & Franklin, C.E. (2013). Each to their own: skeletal muscles of different function use different biochemical strategies during aestivation at high temperature. Journal of Experimental Biology, 216, 1012–1018.
Zasloff, M. (2002). Antimicrobial peptides of multicellular organisms. Nature, 415, 389.
Zhang, J.H., Zhen, Z., Zhang, W.G., Zeng, T. & Zhou, G.H. (2009). Effect of intensifying high-temperature ripening on proteolysis, lipolysis and flavor of Jinhua ham. Journal of The Science of Food and Agriculture, 89, 834–842.
Zhang, W., Xiao, S., Samaraweera, H., Lee, E.J. & Ahn, D.U. (2010). Improving functional value of meat products. Meat Science, 86, 15–31.
Zhu, C.-Z., Zhang, W.-G., Zhou, G.-H., Xu, X.-L., Kang, Z.-L. & Yin, Y. (2013). Isolation and identification of antioxidant peptides from Jinhua ham. Journal of Agricultural and Food Chemistry, 61, 1265–1271.
Zhu, C.Z., Zhang, W.G., Zhou, G.H. & Xu, X.L. (2016). Identification of antioxidant peptides of Jinhua ham generated in the products and through the simulated gastrointestinal digestion system. Journal of the Science of Food and Agriculture, 96, 99–108.
Zhu, C.-Z., Tian, W., Li, M.-Y., Liu, Y.-X. & Zhao, G.-M. (2017). Separation and identification of peptides from dry-cured Jinhua ham. International Journal of Food Properties, 20, S2980–S2989.
Zuo, Q.X., Zhang, W.G., Xing, L.J., Zheng, J.X. & Zhou, G.H. (2017). Stability of angiotensin I-converting enzyme inhibitory activity of peptides extracted from dry-cured Jinhua ham. Journal of Food and Nutrition Research, 5, 301–308.
DOI: 10.1111/ijfs.14132
* Corrispondente: Fax: +86-25-84395341; e-mail: wangang.zhang@njau.edu.cn
© 2019 Institute of Food Science and Technology