ABSTRACT
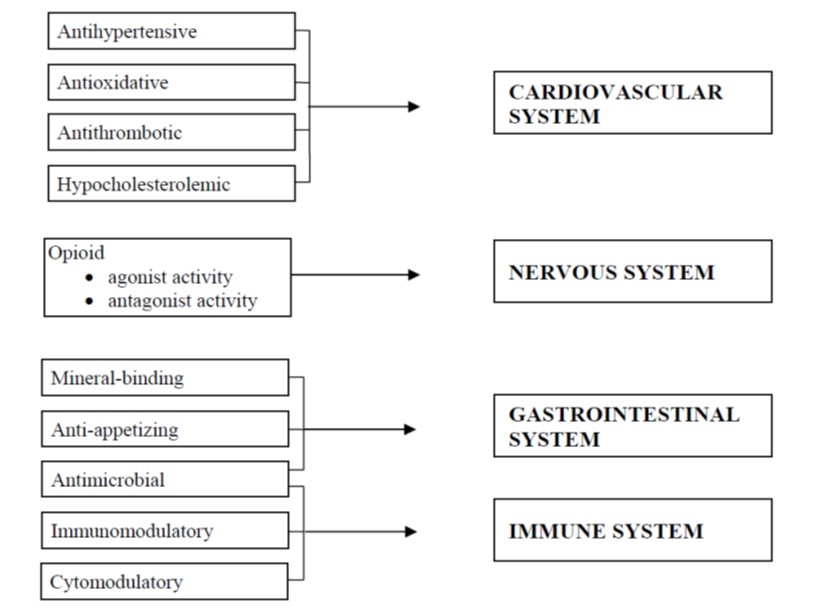
I peptidi bioattivi vengono definiti come specifici frammenti proteici che hanno un impatto positivo sulle funzioni e sulle condizioni corporee e, in ultima analisi, che possono influenzare lo stato di salute [79]. Secondo Fitzgerald & Murray [46] i peptidi bioattivi sono peptidi con attività ormonale o con attività farmaco simile che alla fine modulano la funzione fisiologica attraverso interazioni di legame con recettori specifici presenti sulle cellule bersaglio che portano all’induzione di risposte fisiologiche. In base alle loro proprietà funzionali, i peptidi bioattivi possono essere classificati come antimicrobici, antitrombotici, antipertensivi, oppioidi, immunomodulatori, leganti i minerali e antiossidanti. Questi peptidi svolgono un ruolo importante per la salute umana. In questa review, descriviamo le proprietà sopra indicate dei peptidi bioattivi derivati nello specifico dal latte.
Parole chiave: peptidi bioattivi derivati dal latte, proprietà funzionali, classificazione, salute dell’uomo, attività farmaco-simile, interazioni di legame.
Peptidi a difesa del sistema immunitario
Applicazioni commerciali dei peptidi bioattivi
Possibile importanza fisiologica
I peptidi bioattivi sono proteine sintetizzate nella cellula sotto forma di grandi pre-propeptidi, che vengono poi scissi e modificati per dare prodotti attivi. Come molecole di segnalazione, i peptidi bioattivi svolgono ruoli importanti nelle funzioni fisiologiche e nella patogenesi. L’emergere della bioinformatica e il suo rapido sviluppo, in particolare del progetto sul genoma umano negli anni ’80 e ’90, ha portato ad un rapido accumulo di un’enorme quantità di dati biologici organizzati in numerosi database biologici. Oltre ai grandi archivi di sequenze proteiche e di geni come PIR [53], GeneBank [8] e Swiss-Prot [10], esistono anche molti database che si concentrano su speciali sequenze di proteine o di geni come i database delle proteine nucleari [32] e database di peptidi di immunologia [11]. Il ruolo principale delle proteine del latte è quello di fornire aminoacidi e azoto ai giovani mammiferi e questo alimento rappresenta una fonte importante di proteine alimentari per l’adulto. Le proteine del latte intatte possiedono anche funzioni specifiche, come quella della formazione di micelle. Inoltre, le proteine del latte sono importanti dal punto di vista fisiologico, facilitano l’assorbimento di alcuni nutrienti fondamentali, come oligoelementi e vitamine, e contengono un gruppo di proteine che esercitano una funzione protettiva. Ciò significa che le proteine del latte sono sostanze altamente funzionali. Negli ultimi due decenni è diventato chiaro che le proteine del latte sono una fonte di peptidi biologicamente attivi. Tra questi peptidi biologicamente attivi abbiamo peptidi antiipertensivi, antitrombotici, oppioidi, immunostimolanti, antimicrobici, che legano i minerali e peptidi in grado di abbassare i livelli di colesterolo [149]. Questi peptidi sono inattivi all’interno della sequenza della proteina madre e possono essere liberati durante la digestione gastrointestinale o la lavorazione degli alimenti. Secondo Kamau et al. [76], molti frammenti di peptidi bioattivi possono essere ottenuti mediante l’idrolisi del latte intero o della proteina precursore da parte degli enzimi digestivi. Questo potenzia l’ipotesi dell’esistenza di tali peptidi nel GIT dopo il consumo di latte. La quantità e la composizione del latte, la presenza di altri alimenti, le circostanze, il pH e l’azione degli enzimi determinano la tipologia e il destino dei peptidi rilasciati nell’apparato digerente. Questi fattori sono influenzati dall’età, dal corredo genetico, dai modelli nutrizionali e dallo stato di salute del consumatore. Una dieta sana è quindi un prerequisito per ottenere tutti i benefici derivanti da questi peptidi. Una volta che i peptidi bioattivi vengono liberati, possono agire come composti regolatori con attività ormone-simile. Questo aspetto è stato studiato fin dal 1979 e sono stati individuati numerosi peptidi, che manifestano attività differenti come attività simile a quella degli oppiacei, antitrombotica o antiipertensiva, di immunomodulazione o di utilizzazione dei minerali. Le proteine del latte sono la fonte più importante di peptidi bioattivi, sebbene anche altre proteine animali e vegetali contengano potenziali sequenze bioattive. I primi peptidi biologicamente attivi riscontrati nel latte sono stati i peptidi oppioidi seguiti dai peptidi immunomodulatori. Secondo Haque et al. [59], i peptidi bioattivi derivati dal latte svolgono ruoli vitali per la salute e l’alimentazione dell’uomo. Molti ricercatori sono interessati a risolvere la questione sull’importanza degli alimenti bioattivi, sia come ingredienti dei cibi che come farmaci, quindi è necessario un attento esame. I peptidi ACE inibitori, i peptidi immunomodulanti e i caseino-fosfopeptidi sono i peptidi bioattivi maggiormente scelti per l’applicazione ai generi alimentari formulati per apportare specifici benefici alla salute. I peptidi derivati dalla caseina hanno già trovato interessanti applicazioni come integratori alimentari e come preparati farmaceutici in forma di compresse, dentifrici e materiale per otturazioni dentali. Devono ancora essere dimostrate l’efficacia e la sicurezza di utilizzo di questi peptidi negli animali e nell’uomo.
Peptidi Oppioidi
Secondo Teschemacher et al. [161], i peptidi presenti nei prodotti lattiero-caseari svolgono un ruolo attivo nel sistema nervoso; sono conosciuti come peptidi oppioidi. I peptidi oppioidi possiedono anche una somiglianza farmacologica con l’oppio (morfina). Sono ligandi dei recettori per gli oppioidi con attività agonista o antagonista e sono caratterizzati da sequenze N-terminali distinte e vengono chiamati peptidi oppioidi atipici, per differenziarli dai classici peptidi oppioidi endogeni [161]. I peptidi oppioidi sono brevi sequenze di amminoacidi che imitano l’effetto degli oppiacei nel cervello. I peptidi oppioidi vengono anche definiti come peptidi simili alle encefaline, che hanno sia affinità per il recettore degli oppioidi che effetti simili agli oppiacei, i quali vengono inibiti dal naloxone. I tipici peptidi oppioidi originano tutti a partire da tre proteine precursori: proopiomelanocortina (endorfine), proencefalina (encefalina) e prodinorfina (dinorfine) [65]. I peptidi oppioidi possono essere prodotti dall’organismo stesso, ad esempio le endorfine, oppure essere assorbiti da alimenti parzialmente digeriti (casomorfine, esorfine e rubiscoline). L’effetto di questi peptidi varia, ma tutti sono simili a quelli degli oppiacei. I peptidi oppioidi presenti negli alimenti hanno solitamente lunghezze di 4-8 amminoacidi. Gli oppioidi prodotto dall’organismo sono generalmente molto più lunghi. È noto che i peptidi oppioidi cerebrali svolgono un ruolo importante nella motivazione, nelle emozioni, nel comportamento affettivo, nella risposta allo stress e al dolore e nel controllo dell’assunzione di cibo. Il genoma umano contiene tre geni omologhi noti per codificare peptidi oppioidi endogeni. Ogni gene codifica per una grande proteina che può essere processata per produrre peptidi più piccoli con attività simile a quella degli oppiacei. Tutti questi peptidi oppioidi classici hanno la stessa sequenza N-terminale, cioè Tyr-Gly-Gly-Phe. I peptidi oppioidi esercitano la loro attività legandosi a recettori specifici presenti sulla cellula bersaglio. I singoli recettori sono responsabili di specifici effetti fisiologici, ad esempio il recettore m del comportamento emotivo e della soppressione della motilità intestinale, il recettore s del comportamento emotivo e il recettore k è responsabile della sedazione e dell’assunzione di cibo. I peptidi oppioidi derivati da una varietà di proteine precursori vengono chiamati peptidi oppioidi “tipici”, dato che contengono varie sequenze di amminoacidi nelle loro regioni N-terminali e solo la tirosina N-terminale è conservata. La sequenza N-terminale dei peptidi oppioidi atipici è Tyr-X-Phe o Tyr-X1-X2-Phe. Il residuo di tirosina all’N-terminale e la presenza di un altro amminoacido aromatico in terza o quarta posizione è un importante pattern strutturale che si inserisce nel sito di legame dei recettori oppioidi. I primi peptidi oppioidi derivati dagli alimenti studiati sono state le β-casomorfine [13]. Le proprietà degli oppioidi sono state dimostrate per la β-caseina f60-f70 e per i suoi frammenti. La morficeptina, che è un derivato ammidico della β-casomorfina-4, è un agonista oppioide altamente specifico sia per i recettori m nell’ileo di cavia che per i siti di legame della morfina nel cervello di ratto. Anche altre β-casomorfine sono state identificate come ligandi m [19]. Le β-casomorfine sono state ritrovate in posizioni analoghe anche nella caseina delle pecore, dei bufali d’acqua e in quella dell’uomo [145]. Altri peptidi agonisti degli oppioidi del latte sono le esorfine derivate dalla α-caseina, corrispondenti alla αs1-caseina f90-f96 bovina. Queste esorfine della α-caseina sono ligandi selettivi dei recettori e possono essere separate dall’idrolizzato di pepsina della α-caseina [93, 180]. Tutti i frammenti di k-caseina bovina aventi attività oppioide riferibile alle αs-casossine (k-caseina f33-f39, f25-f34), così come i frammenti di lattoferrina denominati lattoferrossina, si comportano come antagonisti degli oppioidi. L’attività antagonista della casossina (k-caseina f33-f38) è risultata inferiore a quella del naloxone, e può essere considerata come recettori selettivi m e k a bassa affinità [22, 176]. I peptidi oppioidi dalle caseine bovine possono essere ottenuti mediante idrolisi enzimatica in vitro [131]. Precursori delle β-casomorfine sono stati identificati anche nel parmigiano [1]. Le β-casomorfine sono state rilevate nel chimo duodenale dei maialini [101] e nell’intestino tenue umano (Svedberg et al. [158]) come conseguenza della digestione in vivo. Le proteine del siero di latte contengono sequenze simili a quelle degli oppioidi nella loro struttura primaria, vale a dire α-lattoalbumina (sia bovina che umana) f50-f53 e β-lattoglobulina (bovina) f102-f105. Questi peptidi sono stati chiamati α-lattorfina e β-lattorfina [176]. Anche f399 f404 dell’albumina sierica bovina (serorfina) ha attività oppioide [160]. Le β- e le α-lattorfine possono essere rilasciate dalla proteina madre mediante proteolisi in vitro e vari enzimi proteolitici [4]. La α-lattorfina esercita una debole ma costante proprietà oppioide a livello della muscolatura liscia e nel legame al recettore, mentre la β-lattorfina, nonostante la simile affinità di legame al recettore, esercita un effetto stimolante apparentemente di tipo non oppioide sull’ileo della cavia. Le α- e le β-lattorfine sono ligandi dei recettori m [125]. Maruyama et al. [95, 96] hanno dimostrato che i peptidi triptici della αs1-caseina e della β-caseina bovina sono ACE-inibitori. Questi peptidi sono stati chiamati casochinine e corrispondono a αs1-caseina f23-f34, f23-f27 e f194-f199 e a β-caseina f177-f183. Meisel e Schlimme [106] hanno dimostrato che i peptidi sintetici della β-caseina-β-casomorfina-7 (f60-f66) e della β-casochinina-10 (f193-f202) mostrano attività ACE-inibente, nell’intervallo di noti ACE-inibitori derivati dagli alimenti. Il peptide di sintesi β-caseina (f169-f175) ha mostrato una forte attività antipertensiva nei ratti spontaneamente ipertesi. L’attività ACE-inibente di questo peptide era piuttosto bassa ma aumentava dopo digestione pancreatica. Il peptide αs1-caseina (f104-f109) ha avuto una forte attività ACE-inibente ma nessun effetto antipertensivo significativo [94]. Nakamura et al. [120] hanno isolato due peptidi ACE-inibitori Val-Pro-Pro e Ile-Pro-Pro dal latte acido di Calpis. L’attività ACE inibente è stata riscontrata anche nei formaggi stagionati e questa attività aumenta con la stagionatura del formaggio, ma diminuisce quando la proteolisi supera un certo livello. L’attività inibente nel formaggio può derivare da una complessa miscela di piccoli peptidi [103]. È stato dimostrato che i peptidi oppioidi derivati dalle proteine del siero di latte (β-lattorfina e α-lattorfina) inibiscono moderatamente l’attività dell’ACE. Il dipeptide N-terminale (Tyr-Leu) della β-lattorfina è risultato essere l’inibitore più potente [115]. Il peptide triptico β-lattoglobulina, corrispondente alla lattoglobulina f142-f148, è risultato essere il peptide del siero di latte ACE-inibente più attivo finora riportato [115]. La relazione struttura-attività dei peptidi ACE-inibitori non è stata ancora stabilita, poiché è stato visto che una grande varietà di peptidi con diversa sequenza di amminoacidi C-terminali può fungere da substrato. Le correlazioni struttura-attività tra i diversi inibitori peptidici dell’ACE indicano che il legame all’ACE è fortemente influenzato dalla sequenza tripeptidica C-terminale del substrato. È stato ipotizzato che i peptidi che contengono aminoacidi idrofobici in queste posizioni siano dei potenti inibitori. Si ritiene che le catene laterali di questi amminoacidi interagiscano con i siti secondari nel sito attivo dell’ACE [123]. Negli studi sull’inibizione dell’ACE da parte di diverse strutture, è stato riscontrato che un residuo C-terminale di triptofano, tirosina, fenilalanina e prolina risultava essere il più efficace [21]. Dopo l’isolamento degli inibitori peptidici dal veleno di serpente ci si è resi conto che la prolina C-terminale può legarsi eccezionalmente bene all’ACE e può quindi fornire buoni substrati o inibitori a seconda di altre caratteristiche della sequenza [21]. È stato anche visto che i residui di prolina contribuiscono al potenziamento dei peptidi inibitori dell’ACE provenienti dalle proteine alimentari [120]. Inoltre la carica positiva, come nel gruppo guanidina dell’Arg C-terminale, contribuisce alla potenza inibitoria dell’ACE di diversi peptidi, indicando che il sito di legame può essere diverso dal sito catalitico nell’ACE. Utilizzando modelli molecolari è stato dimostrato che i peptidi inibitori possiedono un pattern caratteristico diverso da quello delle molecole inattive: il potenziale positivo si trova quasi sempre nella stessa regione al C-terminale [103]. I peptidi lattorfina sono ligandi del recettore m con una bassa affinità per i recettori degli oppioidi [133]. È stato dimostrato che la α-lattorfina esercita una debole attività oppioide sulla muscolatura liscia e che la β-lattorfina ha un effetto di contrazione sulla muscolatura liscia (Antila et al. [4]). Recentemente, la β-lattorfina si è dimostrata capace di migliorare la funzionalità arteriosa nei SHR. In particolare, la β-lattorfina ha migliorato il rilassamento vascolare in adulti SHR in vitro e inoltre ha migliorato il rilassamento indipendente dell’endotelio [153]. Antagonisti degli oppioidi sono stati trovati nella k-caseina bovina e umana (casossine) e nella αs1-caseina umana [22, 176]. Inoltre, l’antagonista degli oppioidi lattoferrossina è stato individuato nella lattoferrina umana [176]. I peptidi oppioidi derivati dalle proteine del latte sembrerebbero avere un significato fisiologico nell’organismo femminile (liberazione di casomorfina nella ghiandola mammaria) e nei neonati [161]. I peptidi oppioidi somministrati per via orale possono modulare i processi di assorbimento nell’intestino e influenzare la funzionalità gastrointestinale in due modi: in primo luogo agendo sulla muscolatura liscia, che fa ridurre il tempo di transito e, in secondo luogo, influenzando il trasporto intestinale degli elettroliti, che spiegherebbe il loro effetto anti-secretorio. Il miglioramento dell’assorbimento netto di acqua e di elettroliti mediato dalle β-casomorfine nell’intestino tenue e nel crasso è una componente importante della loro azione antidiarroica [20]. Questo effetto potrebbe essere mediato da recettori oppioidi sub-epiteliali o da specifici siti di legame luminale sulla membrana dell’orletto a spazzola [12, 163]. Si dice che le β-casomorfine vengano rapidamente degradate una volta che entrano nel flusso sanguigno. Tuttavia, peptidi oppioidi derivati dalla β-caseina (o loro precursori) sono stati individuati nel chimo duodenale dei maialini, nel plasma dei vitelli appena nati e nell’intestino tenue umano dopo somministrazione orale di caseina o latte [47, 81, 104]. I frammenti oppioidi della caseina non sono stati rilevati nel plasma di mammiferi adulti [161]. Pertanto, ipotizziamo che solo l’intestino dei neonati sarebbe permeabile alle casomorfine, e che grazie a queste molecole i bambini possano calmarsi e addormentarsi più facilmente [155].
Peptidi Immunomodulatori
Peptidi immunomodulatori sono stati individuati sia all’interno delle proteine del latte umano sia in quelle del latte vaccino (Migliore-Samour e Jolles, [110]). Dalla digestione delle proteine del latte umano originano due peptidi, β-caseina f54-f59 e α-lattoalbumina f51-f53, che migliorano l’attività fagocitaria dei macrofagi sia nei topi che nell’uomo e che migliorano la resistenza verso alcuni batteri nei topi [109, 128]. Tra i peptidi immunomodulatori isolati dalle caseine bovine, l’esapeptide C-terminale αs1-caseina (f194-f199)e la β-caseina f191-f193, si sono dimostrati capaci di stimolare i macrofagi. La β-caseina f63-f68 ha stimolato la fagocitosi in vitro, ma questo peptide, così come la β-caseina f191-f193, non è riuscito ad esercitare una protezione nei topi in vivo [43]. La modalità d’azione fisiologica non è nota, ma possono stimolare la proliferazione e la maturazione delle cellule del sistema immunitario. È stato visto che i peptidi sintetici derivati dalle proteine del latte aumentano la proliferazione dei linfociti del sangue periferico umano. Questi peptidi erano Tyr-Gly e Tyr-Gly-Gly e corrispondono a frammenti di k-caseina bovina e di α-lattoalbumina. La β-casomorfina-7 e la β-casochinina-10 si sono dimostrate in grado di sopprimere e di stimolare la proliferazione dei linfociti, a seconda della concentrazione del peptide [77]. Laffienur et al. [84] hanno dimostrato che la β-caseina fermentata dai batteri lattici ha un’attività immunomodulante che potrebbe essere correlata all’interazione con i monociti-macrofagi e con le cellule T helper, in particolare con le cellule simili a Th1. Sutas e i suoi collaboratori [157] hanno dimostrato che le caseine idrolizzate con Lactobacillus GG e con enzimi digestivi generano composti con effetti soppressivi sulla proliferazione dei linfociti. Diversi peptidi immunostimolanti noti sono stati identificati a partire da questi idrolizzati [139]. Un altro gruppo di peptidi che possono essere coinvolti nella stimolazione del sistema immunitario sono gli ACE-inibitori. L’inibizione dell’ACE favorisce la formazione di bradichinina, agendo quindi come immunomodulatori. La bradichinina, nota come mediatore del processo infiammatorio acuto, è in grado di stimolare i macrofagi nel potenziare la migrazione dei linfociti e nell’aumentare la secrezione di linfochinine [126]. In questo contesto va sottolineato che i peptidi αs1-caseina f194-f199, β-caseina f60-f66 e β-caseina f193-f202 hanno dimostrato di possedere sia attività immunostimolante che ACE-inibente. La correlazione struttura-attività e il meccanismo con cui i peptidi derivati dal latte esercitano i loro effetti immunomodulatori non sono ancora del tutto definiti. È stato suggerito che l’arginina nella regione N- o C-terminale del peptide sia un’entità strutturale importante riconosciuta da specifici recettori presenti sulla membrana [126]. Una caratteristica strutturale comune tra alcuni peptidi immunomodulatori è la presenza di arginina nel C-terminale. È stato anche scoperto che i peptidi immunomodulatori stimolano la proliferazione dei linfociti umani, l’attività di fagocitosi dei macrofagi e la sintesi di anticorpi. I peptidi possono stimolare la proliferazione e la maturazione delle cellule T e delle cellule natural killer per la difesa dei neonati contro un gran numero di batteri, in particolare di batteri enterici (Clare e Swaisgood, [25]). Secondo i risultati di Migliore-Samour et al. [109], gli immunopeptidi derivati dalla caseina, inclusi frammenti di αs1-caseina e β-caseina, stimolano la fagocitosi dei globuli rossi di pecora da parte dei macrofagi peritoneali murini ed esercitano un effetto protettivo contro l’infezione da Klebsiella pneumoniae nei topi dopo somministrazione endovenosa. Secondo Korhonen e Pihlanto [81], i peptidi del latte immunomodulatori possono alleviare le reazioni allergiche negli esseri umani che soffrono di atipia e migliorare l’immunità della mucosa nel tratto gastrointestinale. In questo modo i peptidi immunomodulatori possono anche essere utili nella regolazione dello sviluppo del sistema immunitario nei neonati. Ancora una volta, è stato dimostrato che i peptidi immunomodulatori che si formano durante la fermentazione del latte contribuiscono agli effetti antitumorali [99]. La lattoferricina, uno dei peptidi multifunzionali, possiede proprietà antimicrobiche, antimicotiche, antitumorali e antivirali grazie alla ricca percentuale di triptofano/arginina presente in essa e proprietà antinfiammatorie e immunomodulanti a causa della regione della sua molecola carica positivamente [169]. I peptidi derivati dagli idrolizzati di lattoferricina possono essere utili per applicazioni cliniche visti i loro effetti immunomodulatori o per la chemioprevenzione della carcinogenesi. L’utilizzo dei derivati della lattoferricina nella cura del cavo orale e come conservanti alimentari è stato proposto anche da Expósito e Recio nella loro review [91].
Peptidi che legano i minerali
Diversi fosfopeptidi contenenti la sequenza cluster -Ser(P)-Ser(P)-Ser(P)-Glu(E)- Glu(E)- sono stati identificati a partire dalla caseina bovina intera. Queste sequenze forniscono ai peptidi la capacità unica di mantenere Ca, P e altri minerali in una soluzione a pH intestinale. Diversi fosfopeptidi sono stati individuati nel digerito enzimatico delle proteine del latte, ad esempio: αs1-caseina f43-f58, f59-f79, f43-f79, αs2-caseina f1-f24 e f46-f70 e β-caseina f1-f28, f2-f28, f1-f25, f33-f48 [49, 75]. Il carattere altamente anionico di questi peptidi li rende resistenti ad ulteriori attacchi proteolitici, consente loro di formare complessi solubili con il calcio e previene la formazione di fosfato di calcio insolubile [6, 143]. La percentuale di fosfopeptidi che interagiscono con il fosfato di calcio colloidale è correlata al loro contenuto relativo di residui di fosfoserina [49]. Varie frazioni di fosfopeptidi hanno mostrato differenze significative nelle loro attività di legame al calcio, che possono essere dovute alla composizione variabile di amminoacidi intorno alla regione fosforilata [102]. La formazione di caseinofosfopeptidi è stata osservata durante la digestione in vitro di caseine bovine e specifici residui di caseinofosfopeptidi sono stati identificati nel contenuto intestinale dei maialini dopo l’ingestione di una dieta contenente caseina [100]. Il caseinfosfopeptide può formarsi anche durante la stagionatura del formaggio a causa dell’attività della plasmina e della proteasi microbica [141, 152].
Peptidi antitrombotici
Somiglianze funzionali tra latte e coagulazione del sangue, nonché omologie di sequenza, esistono nella catena g del fibrinogeno e nella k-caseina [72]. Jolles et al. [73] hanno dimostrato che la k-caseina f106-f116 bovina inibisce l’aggregazione piastrinica e si lega con il sito sul recettore, prevenendo di conseguenza il legame del fibrinogeno con le piastrine del sangue. Questa inibizione era dipendente dalla concentrazione del peptide. I due peptidi triptici più piccoli (k-caseina f106-f112 e f113-f116) esercitavano un effetto molto più lieve sull’aggregazione piastrinica e non inibivano il legame del fibrinogeno. Questi peptidi vengono indicati come casoplateline. Il comportamento della k-caseina f106-f116 è simile a quello del peptide C-terminale della catena g del fibrinogeno umano [43]. Il meccanismo coinvolto nella coagulazione del latte, determinato dall’interazione della k-caseina con la chimosina, presenta una notevole somiglianza con il processo coinvolto nella coagulazione del sangue, determinata dall’interazione del fibrinogeno con la trombina [74]. Il frammento di k-caseina denominato casoplatelina, ottenuto da idrolizzati triptici, presenta attività antitrombotica in quanto va ad inibire il legame del fibrinogeno con le piastrine [73, 74]. Questi peptidi vengono rilasciati durante la digestione gastrointestinale e assorbiti intatti nel sangue, il che supporta il concetto che siano capaci di esercitare un effetto antitrombotico in vivo. I potenziali effetti fisiologici di questi peptidi antitrombotici non sono stati stabiliti, ma tali peptidi sono stati individuati nel plasma dei neonati dopo l’allattamento al seno o l’ingestione di latte artificiale formulato per lattanti [18].
Peptidi antimicrobici
L’attività antimicrobica del latte è principalmente associata alle proteine del siero minori, soprattutto la lattoferrina. Questa proteina ha proprietà batteriostatiche e battericide attribuibili alla sua capacità di chelare il ferro o di legarsi alla superficie dei batteri. Tomita et al. [164] hanno scoperto che la digestione con pepsina della lattoferrina bovina produce un potente peptide battericida e che la potenza antimicrobica dell’idrolizzato era superiore a quella della lattoferrina non digerita. Dionysius e Milne [33] hanno identificato due peptidi su N-terminale della lattoferrina con attività antimicrobica verso una serie di microrganismi patogeni e di responsabili del deterioramento degli alimenti. Secondo la ricerca di Lahov e Regelson [85], il meccanismo battericida è indipendente dal ferro, perché i peptidi identificati sono distinti dal sito di legame del ferro della molecola. È possibile che i peptidi attivi abbiano un’affinità per la superficie cellulare batterica e agiscano interrompendo le funzioni essenziali della membrana. Nessun effetto è stato rilevato contro i bifidobatteri; pertanto, i peptidi derivati dalla lattoferrina possono influenzare positivamente la flora intestinale. L’αs-caseina f1-f23, ottenuta a partire dall’idrolisi della chimosina, ha mostrato di avere attività antibatterica contro Satphylococcus aureus e Candida albicans [85]. Nelle review scritte da Lopez-Fandino et al. [92] e da Murray & FitzGerald [117] viene descritto che, tra i diversi gruppi di peptidi bioattivi, i peptidi inibitori dell’enzima di conversione dell’angiotensina (ACE) stanno guadagnando particolare attenzione, a causa della prevalenza e dell’importanza dell’ipertensione nella popolazione occidentale. L’ACE può giocare un ruolo importante nella prevenzione e nel trattamento dell’ipertensione. Secondo Jauhiainen & Korpela [68], il consumo di alimenti contenenti peptidi antipertensivi produce una significativa riduzione della pressione sanguigna [68]. Oggi è ampiamente riconosciuto che il concetto di AMP potrebbe giocare un ruolo promettente nella lotta contro l’attuale e diffusa resistenza dei batteri agli antibiotici convenzionali [70, 178]. È trascorso solo un breve periodo di tempo prima che le pressioni selettive consentissero a questi determinanti di resistenza ambientale di essere incorporati nei batteri patogeni che venivano trattati con i nuovi antibiotici [16]. Inoltre, le pratiche mediche e di allevamento degli ultimi 50 anni hanno promosso lo sviluppo e la diffusione della resistenza nei patogeni sia umani che animali, compromettendo l’efficacia della chemioterapia per le malattie infettive [134]. Oggi numerosi ed importanti agenti patogeni sono resistenti a più classi di antibiotici, andando a comprendere la maggior parte, se non tutti, gli antibiotici clinicamente utilizzabili. Le infezioni causate da questi cosiddetti organismi multiresistenti (MDR) sono costose da trattare e il trattamento è sempre più soggetto al fallimento [29, 31]. L’antibiotico-resistenza dei batteri può presentarsi in molti modi, tipicamente si basata sull’inattivazione del farmaco [170] o sulla modificazione/mutazione del sito bersaglio [86]. Per alcune classi di antibiotici un importante meccanismo di resistenza è rappresentato anche dal ridotto accumulo dei farmaci in seguito ad un assorbimento limitato o dall’aumento dell’efflusso [88]. Un altro meccanismo è quello della resistenza fenotipica dovuta a modalità di crescita specifiche (es. biofilm) durante l’infezione. È prevalente tra i patogeni batterici e probabilmente svolge un ruolo importante nella resistenza in vivo e nel fallimento del trattamento nonostante le indicazioni di suscettibilità ai farmaci in vitro [154]. Nel complesso, l’impatto clinico dell’antibiotico-resistenza è immenso ed è caratterizzato da un aumento dei costi, della durata della degenza ospedaliera e della mortalità. Pertanto, è giunto il momento di considerare nuove classi di antibiotici, tra cui gli AMP [57], la cui modalità d’azione promette sia una bassa suscettibilità ai meccanismi MDR sia un’elevata attività contro una vasta gamma di microrganismi [41]. Gli AMP vengono prodotti dalla maggior parte delle specie viventi, dai procarioti [5, 165] alle piante [44, 52], dagli insetti [14, 56, 118] agli anfibi [20, 28, 114, 121, 177] fino ai mammiferi compresi gli esseri umani [50, 51], come parte del meccanismo di difesa dell’organismo da parte dell’ospite. Come principali effettori del sistema immunitario innato, gli AMP vanno a completare il sistema immunitario adattativo altamente specifico ma relativamente lento [51]. A differenza dei meccanismi immunitari acquisiti, gli AMP endogeni, che sono espressi o indotti costitutivamente, forniscono mezzi di difesa rapidi ed efficaci. La maggior parte di questi peptidi codificati dal gene viene mobilitata poco dopo l’infezione microbica e agisce rapidamente per neutralizzare un ampio spettro di agenti patogeni [150].
Peptidi Antiossidanti
L’importanza del processo di ossidazione nel corpo e negli alimenti è stata ampiamente riconosciuta. Il metabolismo ossidativo è essenziale per la sopravvivenza delle cellule. Un effetto collaterale di questo processo è la produzione di radicali liberi e di altre specie reattive dell’ossigeno che causano danni ossidativi. Quando si forma un eccesso di radicali liberi questo può andare a sopraffare gli enzimi protettivi (come la superossido dismutasi, la catalasi e la perossidasi) con effetti distruttivi e letali sulle cellule (ad esempio apoptosi) attraverso l’ossidazione dei lipidi di membrana, delle proteine cellulari, del DNA e degli enzimi bloccando così il processo cellulare. Recenti studi hanno dimostrato che i peptidi antiossidanti possono essere rilasciati dalle caseine durante l’idrolisi mediata dagli enzimi digestivi e durante la fermentazione del latte con ceppi di batteri lattici proteolitici [81]. La maggior parte dei peptidi identificati derivano dalla αs-caseina ed hanno dimostrato di possedere attività di scavenging dei radicali liberi e di inibire la perossidazione lipidica enzimatica e non enzimatica, molto probabilmente essendo un bersaglio preferito rispetto ai radicali liberi degli acidi grassi [138]. Il consumo di latte di capra fermentato ha migliorato l’effetto anti-aterogenico in soggetti sani, prolungando la resistenza della frazione lipoproteica all’ossidazione, abbassando i livelli di lipoproteine perossidate, di LDL ossidate, di 8-isoprostani e della reazione redox del glutatione e potenziando l’attività antiossidante totale [83]. Pertanto, si ipotizza che bassi livelli di antiossidanti possano far aumentare la malattia coronarica. Sono necessarie ulteriori ricerche per chiarire il ruolo dei peptidi antiossidanti nelle funzioni protettive nell’uomo.
Peptidi Antiipertensivi
Peptidi antipertensivi sono stati trovati nei prodotti lattiero-caseari trasformati (formaggio, latte, ecc.) senza alcun ruolo funzionale intenzionale. Lattotripeptidi isoleucina-prolina-prolina (Ile-Pro-Pro) e valina-prolina-prolina (Val-Pro-Pro) sono stati ritrovati nel latte acido [120]. Anche diversi formaggi di origine svizzera contengono gli stessi tripeptidi. La concentrazione di Ile-Pro-Pro e Val-Pro-Pro sembrerebbe aumentare nel corso del processo di maturazione, raggiungendo i 100 mg/kg dopo 4-7 mesi. Si è scoperto che la frazione sierica di prodotti simili allo yogurt contiene un dipeptide Tyr-Pro, che genera un significativo effetto antipertensivo nei ratti spontaneamente ipertesi (SHR) [173]. Sebbene sia stato dimostrato che caseina e siero di latte riducono la pressione sanguigna anche tal quali, la ricerca si è concentrata sui prodotti della loro degradazione, i peptidi [127]. I peptidi possono originarsi dalla loro proteina madre mediante idrolisi enzimatica durante la digestione gastrointestinale, la fermentazione del latte con colture starter proteolitiche o l’idrolisi da parte di enzimi ottenuti da microrganismi [130]. Se la struttura del peptide è nota, è possibile anche sintetizzare i peptidi mediante sintesi chimica, tecnologia del DNA ricombinante o sintesi enzimatica. L’idrolisi della caseina con pepsina genera peptidi antipertensivi e i peptidi dotati di tale attività sono stati identificati. I più potenti peptidi ACE-inibitori trovati in questi idrolizzati corrispondevano alle sequenze RYLGY, AYFYPEL e YQKFPQY. Queste tre sequenze hanno un’attività di scavenging dei radicali in vitro ed esercitano anche una significativa attività antipertensiva quando somministrate per via orale a SHR a dosi di 5 mg/kg di peso corporeo. Va evidenziato che l’effetto antipertensivo riscontrato per i peptidi RYLGY e AYFYPEL è paragonabile all’attività del Val-Pro-Pro, peptide antiipertensivo già presente negli alimenti funzionali. Queste sequenze, unitamente alla loro attività antipertensiva, sono state mostrate per la prima volta in questo studio. Sono già in corso ulteriori studi per valutare la resistenza di queste sequenze agli enzimi gastrointestinali e la somministrazione prolungata dell’idrolizzato totale in SHR [26]. È ormai ben noto che l’ipertensione rappresenta uno dei principali fattori di rischio per una serie di malattie cardiovascolari (CVD). Il rischio di sviluppare malattie cardiovascolari è direttamente correlato al livello di pressione sanguigna. Ciò è controllato da una serie di percorsi biochimici che interagiscono tra di loro. Il controllo della pressione sanguigna è in parte associato al sistema renina-angiotensina. L’enzima di conversione dell’angiotensina I (ACE) è un ectoenzima multifunzionale che si trova in diversi tessuti e che svolge un ruolo importante nella regolazione della pressione sanguigna. La renina agisce sull’angiotensinogeno, precursore inattivo, liberando così il decapeptide angiotensina I. L’ACE rimuove ulteriormente il dipeptide C-terminale HL dall’angiotensina I determinando la formazione di angiotensina II, un potente vasocostrittore. L’ACE rimuove anche il dipeptide C-terminale dalla bradichinina (potente vasodilatatore) con conseguente formazione di un frammento proteico inattivo. Pertanto, l’inibizione dell’ACE si traduce principalmente in un effetto ipotensivo, ma può anche influenzare diversi sistemi regolatori coinvolti nell’attività del sistema immunitario e di quello nervoso [107]. Gli ACE-inibitori derivati dalle proteine del latte sono rappresentati da diversi frammenti di caseina, denominati casochinine o delle proteine del siero, denominate lattochinine [45]. Due potenti peptidi ACE-inibitori provenienti dalla β-caseina, f84-f86 (che corrisponde a Val-Pro-Pro) e f74-f76 (che corrisponde a Ile-Pro Pro) e uno dalla k-caseina, f108-f110 (che corrisponde a Ile -Pro-Pro) sono stati purificati dal “Calpis”, una bevanda analcolica giapponese a base di latte scremato bovino fermentato con Lactobacillus helveticus e Saccharomyces cerevisiae [120]. Una singola somministrazione orale di latte acido contenente questi due tripeptidi a ratti spontaneamente ipertesi (SHR) con un dosaggio di 5 ml/kg di peso corporeo ha ridotto significativamente la pressione sanguigna sistolica dalle 6 alle 8 ore dopo la somministrazione [120]. L’effetto antipertensivo di questi peptidi sintetizzati chimicamente è stato osservato anche 2-8 ore dopo la somministrazione e gli effetti risultavano essere dose dipendenti. Questi due tripeptidi sono stati isolati anche dall’idrolizzato di caseina prodotto dall’enzima proteasi extracellulare di Lactobacillus helveticus CP790 [172]. Utilizzando la stessa proteasi, Maeno et al. [94] hanno identificato un peptide antiipertensivo derivato dalla β-caseina a partire dall’idrolizzato di caseina. L’effetto antipertensivo di questo peptide era dose-dipendente in SHR, a un livello di dosaggio compreso tra 0.2-2 mg/kg di peso corporeo. Questo peptide non ha mostrato una forte attività ACE-inibente di per sé, ma un corrispondente esa-peptide sintetico deleto da Gln (Lys-Val-Leu-Pro-Val-Pro) ha mostrato una forte attività ACE-inibente così come un effetto antipertensivo in SHR. Ciò suggerisce la possibile attivazione dei peptidi nel tratto digerente. È stato dimostrato che un tetrapeptide isolato dalla β-lattoglobulina f142-f145, denominato “β-lattosina B” ha una significativa attività antiipertensiva quando somministrato per via orale a ratti spontaneamente ipertesi [116]. Uno studio condotto su volontari umani normotesi e lievemente ipertesi ha riportato che l’ingestione due volte al giorno di 10 g di un digerito tripsico di caseina per 4 settimane aveva un effetto antipertensivo [147]. In uno studio controllato con placebo, la pressione sanguigna dei pazienti ipertesi è diminuita significativamente dopo 4-8 settimane di ingestione giornaliera di 95 ml di latte acido “Calpis” contenente tripeptidi IPP e VPP [62]. Non sono stati osservati cambiamenti importanti della pressione sanguigna nel gruppo placebo. La dose ingerita di questi peptidi ACE-inibitori era nell’intervallo di soli 1.2-1.6 mg [62, 61]. Questi risultati sono stati supportati da un recente studio controllato randomizzato in doppio cieco in cui l’effetto del “Calpis” era evidenziato in uomini ipertesi borderline dopo somministrazione orale di 160 g di prodotto per 4 settimane [111]. La pressione sanguigna sistolica nel gruppo di prova è diminuita significativamente dopo 2 e 4 settimane di consumo di “Calpis”. Non è stata osservata alcuna variazione significativa della pressione sanguigna nel gruppo placebo, a cui è stato somministrato latte acidificato non fermentato. Recentemente è stato condotto uno studio tra pazienti con pressione sanguigna normalmente elevata e con ipertensione lieve, che assumevano diverse dosi di idrolizzato di caseina prodotto con Aspergillus oryzae contenente IPP e VPP [112]. I volontari che consumavano una dose giornaliera di 1.8 mg di IPP e VPP hanno mostrato una significativa diminuzione della pressione sanguigna sistolica (SBP) dopo 6 settimane e in quelli che hanno ricevuto 2.5 o 3.6 mg, questo beneficio è stato già registrato a 3 settimane dalla somministrazione. Inoltre, è stata osservata anche una differenza significativa nella SBP tra il gruppo placebo e il gruppo IPP e VPP che riceveva 3.6 mg. Due diversi studi condotti sull’uomo con Evolus hanno riportato una diminuzione staticamente significativa della SBP di 10 e 6.7 mm Hg rispetto ai controlli (latte acidificato e un latte fermentato con ceppo misto di Lactococcus) dopo, rispettivamente, 8 e 21 settimane di ingestione di 150 ml da parte di volontari lievemente ipertesi. Anche altri due prodotti commerciali, un idrolizzato della caseina (Casein DP, Kanebo, Ltd., Giappone e C12 peptide, DMV, Paesi Bassi) e un idrolizzato di proteine del siero di latte (Biozate, Davisco, USA) sono stati dichiarati in grado di abbassare la pressione sanguigna nell’uomo [45]. I peptidi ACE-inibitori derivati dai prodotti lattiero-caseari non sono potenti quanto i farmaci usati per il trattamento dell’ipertensione, ma mantengono la promessa di essere agenti terapeutici sicuri e naturali senza alcun effetto collaterale negativo. Il potenziale antipertensivo dei peptidi derivati dalle proteine del latte dipende dalla capacità di questi peptidi di raggiungere il sito bersaglio senza essere degradati e di conseguenza inattivati dall’azione delle peptidasi intestinali o plasmatiche. La resistenza alla degradazione da parte della peptidasi può essere considerata un prerequisito per un effetto antipertensivo durante l’ingestione orale e l’infusione endovenosa di idrolizzati/peptidi ACE-inibitori. Ad esempio, la caseina αs1 f23-f27, un potente ACE-inibitore in vitro, ha dimostrato di non avere effetti ipotensivi in vivo [95]. La presenza di Val-Pro-Pro e Ile-Pro-Pro in frazioni aortali solubilizzate trattate termicamente di SHR alimentati con latte acido “Calpis” dimostra la resistenza di questi peptidi alle peptidasi intestinali e circolatorie, oltre all’assorbimento di questi peptidi dall’intestino [98]. I peptidi contenenti prolina sono generalmente resistenti alla degradazione da parte degli enzimi digestivi [78, 2]. Inoltre, è stato visto che i tripeptidi contenenti Pro-Pro in C-terminale sono resistenti alle peptidasi specifiche della prolina [113]. È interessante notare che il peptide triptico, β-lattoglobulina f142-f148, era resistente all’ulteriore degradazione da parte della pepsina e della chimotripsina [115]. D’altra parte, la degradazione o frammentazione del peptide può provocare attività di ACE inibizione più potente. Ad esempio, la rimozione della glutammina C-terminale dalla β-caseina f169-f175 ha fatto aumentare la potenza di inibizione dell’ACE in vitro a partire da 1000 fino a 5 mmol/l, tuttavia, sia la β-caseina f169-f174 che la f169-f175 avevano forti attività antipertensive nei SHR [94]. Questi risultati sottolineano la necessità di eseguire studi in vivo in tutti i casi. È molto difficile stabilire una relazione diretta tra attività in vitro e in vivo. Ciò è dovuto principalmente alla biodisponibilità dei peptidi ACE-inibitori dopo somministrazione orale e al fatto che i peptidi possono influenzare la pressione sanguigna con meccanismi diversi da quelli degli ACE-inibitori. Per esercitare un effetto antipertensivo dopo ingestione orale, i peptidi ACE-inibitori devono raggiungere il sistema cardiovascolare in forma attiva. Pertanto, devono rimanere attivi durante la digestione da parte delle proteasi umane ed essere trasportati nel sangue passando la parete intestinale. È stata studiata la biodisponibilità di alcuni peptidi ACE-inibitori. È risaputo anche che i peptidi contenenti prolina sono generalmente resistenti alla degradazione da parte degli enzimi digestivi. I peptidi possono essere assorbiti intatti attraverso l’intestino per via paracellulare e transcellulare, ma la potenza della bioattività dopo l’assorbimento è inversamente correlata alla lunghezza della catena [168]. È interessante notare che i peptidi ACE-inibitori sono anche correlati alla salute delle ossa. Il polimorfismo dell’ACE causa una diminuzione della sua attività e questo sembrerebbe essere correlato con una maggiore densità minerale ossea [129]. È stato riportato che l’Ang II influisce sull’osso, diminuendo la differenziazione degli osteoblasti e aumentando il riassorbimento osseo osteoclastico [58, 63]. L’inibizione dell’ACE aumenta la formazione del fattore di crescita endoteliale vascolare, importante per la formazione ossea [64]. Dall’altro lato la bradichinina aiuta indirettamente nella formazione dell’osso come descritto da Van’t Hof et al. [167] nel loro articolo di review. È stato dimostrato che gli ACE-inibitori moltiplicano l’attività della bradichinina. In conclusione, l’inibizione dell’ACE può influenzare lo sviluppo dell’osso attraverso l’inibizione dell’Ang II o l’attivazione della bradichinina.
Peptidi a difesa del sistema immunitario
I sistemi coinvolti nella difesa del corpo umano contro gli invasori sono piuttosto complessi e, notoriamente, la dieta può giocare un ruolo importante in questo aspetto. La ricerca sul ruolo dei peptidi funzionali è piuttosto recente ma sembra essere promettente. Le due attività principali svolte da questi peptidi sono quella di immunomodulazione (stimolazione del sistema immunitario) e quella antimicrobica (inibizione dei batteri patogeni). Diversi peptidi derivati dalla caseina e dalle proteine del siero di latte mostrano capacità di immunomodulazione e, in questo caso, viene avviata una cascata completamente separata di risposte di difesa dell’ospite. È stato scoperto che i peptidi immunomodulatori stimolano la proliferazione dei linfociti umani, l’attività fagocitaria dei macrofagi e la sintesi di anticorpi. I peptidi possono stimolare la proliferazione e la maturazione delle cellule T e delle cellule natural killer per la difesa dei neonati contro un gran numero di batteri, in particolare dei batteri enterici [25]. Gli immunopeptidi derivati dalla caseina, inclusi frammenti di αs1-caseina e β-caseina, stimolano la fagocitosi dei globuli rossi di pecora da parte dei macrofagi peritoneali murini ed esercitano un effetto protettivo contro l’infezione da Klebsiella pneumoniae nei topi dopo somministrazione endovenosa [109]. La sequenza C-terminale della β-caseina 193-209 contenente β-casochinina-10 ha indotto una significativa risposta proliferativa nei linfociti di ratto [27]. A seconda della concentrazione del peptide, la β-casochinina-10 e la β-casomorfina-7 si sono dimostrate in grado di sopprimere e di stimolare la proliferazione dei linfociti. La β-casomorfina-7 inibisce la proliferazione dei linfociti della lamina propria del colon umano, dove l’effetto anti-proliferativo viene invertito dall’antagonista del recettore degli oppioidi naloxone [40]. Inoltre, è stato suggerito che i peptidi del latte immunomodulatori possono attenuare le reazioni allergiche negli esseri umani atopici e migliorare l’immunità della mucosa nel tratto gastrointestinale [81]. In questo modo, i peptidi immunomodulatori possono regolare lo sviluppo del sistema immunitario nei neonati. Inoltre, è stato dimostrato che gli immunopeptidi che si formano durante la fermentazione del latte contribuiscono agli effetti antitumorali [99]. Recenti studi si sono concentrati sulle proprietà di potenziamento immunologico dei caseinofosfopeptidi. Hata et al. [62] hanno riportato l’azione immunostimolante dei fosfopeptidi αs1-CN (f59-f79)5P, αs2-CN (f1-f32)4P e β-CN (f1-f25)4P, i quali hanno potenziato la produzione di immunoglobuline IgG nelle colture cellulari di milza di topo. Inoltre, il livello di IgA specifiche per l’antigene sierico e intestinale era più alto nei topi alimentati con i caseinofosfopeptidi rispetto a quelli alimentati con la dieta di controllo. Un altro gruppo di peptidi che possono essere coinvolti nella stimolazione del sistema immunitario sono gli ACE-inibitori. L’inibizione dell’ACE favorisce la formazione di bradichinina e agisce quindi come immunomodulatore. La bradichinina, nota come mediatore del processo infiammatorio acuto, è in grado di stimolare i macrofagi per favorire la migrazione dei linfociti e aumentare la secrezione di linfochinine [126]. I frammenti peptidici di αs1-caseina f194-f199 e di β-caseina f60-f66 e f193-f202 hanno dimostrato di avere sia attività immunostimolante che ACE-inibente. La correlazione struttura-attività e i meccanismi mediante i quali i peptidi derivati dal latte esercitano i loro effetti immunomodulatori non sono ancora definiti. È stato suggerito che l’arginina nella regione N- o C-terminale del peptide sia un’entità strutturale importante riconosciuta da specifici recettori di legame sulla membrana [126]. L’attività immunostimolante dei caseinofosfopeptidi è attribuibile a residui fosfoserilici, [62] e il sito di fosforilazione sembrerebbe essere un epitopo allergenico nelle caseine [9]. I risultati ottenuti con i linfociti umani suggeriscono che i peptidi oppioidi possono influenzare la reattività immunitaria dei linfociti tramite il recettore degli oppioidi. Pertanto, esiste una relazione notevole tra il sistema immunitario e i peptidi oppioidi, poiché sui linfociti sono presenti i recettori μ degli oppioidi per le endorfine (Elitsur et al. [40]). È stato dimostrato che i peptidi contenenti glutammina possono sostituire liberamente l’aminoacido glutammina, necessario per la proliferazione dei linfociti e molto utilizzato dalle cellule immunocompetenti, anche quando si ritrovano in uno stato di riposo [17]. Pertanto, tali peptidi esercitano un’immunostimolazione non specifica come risultato delle loro proprietà trofiche. Gli immunopeptidi hanno potenziali applicazioni come integratori nel mantenimento della salute immunitaria. Ad esempio, possono potenzialmente fornire una certa protezione contro le infezioni che coinvolgono batteri, virus e parassiti. In alternativa, i peptidi immunosoppressori potrebbero essere tenuti in considerazione per alcune applicazioni mediche come la prevenzione del rigetto degli innesti o dei trapianti e nella regolazione del processo infiammatorio coinvolto in varie malattie autoimmuni [54]. Le proprietà antimicrobiche del latte sono ampiamente riconosciute da molti anni. L’attività antimicrobica del latte è principalmente attribuita alle immunoglobuline e alle proteine non immunitarie, come la lattoferrina, la lattoperossidasi e il lisozima. È noto da tempo che l’allattamento al seno dei bambini fornisce protezione da una serie di infezioni enteriche e respiratorie. I peptidi antibatterici sono riconosciuti come una componente importante dell’immunità innata, in particolare se parliamo delle superfici delle mucose e di organi come i polmoni e l’intestino tenue, che sono costantemente esposti ad una serie di potenziali agenti patogeni. La carica anfifilica e quella positiva vengono riconosciute come i principali motivi strutturali che determinano l’interazione con le membrane batteriche, che rappresentano il bersaglio comune del loro meccanismo d’azione. È stato dimostrato che alcuni peptidi antibatterici derivati dal latte possono raggiungere bersagli intracellulari. Uno dei peptidi antimicrobici più potenti finora descritti corrisponde ad un frammento della proteina del siero lattoferrina, ed è denominato lattoferricina [7]. La struttura e l’attività del frammento di lattoferriccina sono state studiate nell’ultimo decennio. È stato suggerito che mentre le proprietà antimicrobiche, antimicotiche, antitumorali e antivirali della lattoferriccina possono essere correlate alla ricca percentuale di triptofano/arginina del peptide, le proprietà antinfiammatorie e immunomodulatorie risultano essere più correlate ad una regione della molecola caricata positivamente [169]. I peptidi derivati dagli idrolizzati LF possono essere utili per applicazioni cliniche, visti i loro effetti immunomodulatori o durante la chemio-prevenzione della carcinogenesi. Secondo Exposito et al. [91], l’impiego di derivati LF può essere utile anche nell’igiene orale e come conservante alimentare. Successivamente, anche altre proteine del siero di latte come la α-lattoalbumina e la β-lattoglobulina sono state prese in considerazione come potenziali precursori di frammenti antibatterici. Analogamente, frammenti antibatterici derivano anche da αs1-, αs2- e k-caseina [85]. Questi peptidi sono risultati attivi contro un’ampia gamma di organismi patogeni, ad esempio Escherichia, Helicobacter, Listeria, Salmonella e Staphylococcus, lieviti e funghi filamentosi. A seconda dei ceppi batterici bersaglio, le concentrazioni inibitorie dei peptidi variano; ad esempio, i peptidi antimicrobici αs2-CN f183-f207 e f164-f179 hanno mostrato inibizione contro batteri gram positivi e negativi con MIC (concentrazione minima inibente) che vanno da 8 a 95 μmol/l [85]. I peptidi antibatterici possono aiutare a proteggere dai patogeni, specialmente nel tratto intestinale dei neonati e quindi supportare le difese non immunitarie dell’intestino. D’altra parte, questi peptidi possono trovare interessanti applicazioni nel campo della sicurezza alimentare e come prodotti farmaceutici. Secondo quanto descritto da Jakala e Vapaatalo [67] nella loro review, l’effetto di abbassamento della pressione sanguigna è stato confermato in diversi modelli animali di ipertensione umana. Ci sono anche prove del loro effetto benefico sulla vascolarizzazione. Tutti questi effetti potrebbero essere correlati all’inibizione dell’ACE. L’evidenza clinica dell’effetto antipertensivo dei lattotripeptidi è più controversa. Jakala e Vapaatalo [67] suggeriscono che i prodotti contenenti lattotripeptidi potrebbero essere una valida opzione come trattamento non farmacologico e nutrizionale della pressione sanguigna elevata.
Applicazioni commerciali dei peptidi bioattivi
I peptidi bioattivi hanno suscitato un forte interesse come candidati di spicco per vari alimenti funzionali in grado di promuovere la salute. Attualmente, le proteine del latte sono la fonte più conosciuta di tali ingredienti, ma fino a poco tempo fa la produzione commerciale di peptidi bioattivi derivati dal latte è stata limitata dalla mancanza di tecnologie adeguate su larga scala. Le tecniche di separazione con membrana sembrerebbero essere la migliore tecnologia disponibile per la raccolta di peptidi con uno specifico range di peso molecolare [79, 82, 135]. Le tecniche di nanofiltrazione e di ultrafiltrazione vengono ora impiegate a livello industriale per produrre ingredienti che contengano peptidi bioattivi specifici a base di caseina o idrolizzati di proteine del siero di latte. Tali preparati sono disponibili in commercio e vengono inseriti in diversi prodotti di consumo, come bevande a base di latticini e frutta, dolciumi, gomme da masticare, pastiglie e capsule. I prodotti attualmente in commercio contengono peptidi con proprietà anti-cariogeniche, antiipertensive, di legare i minerali, antistress e anoressizzanti. Solo pochi tra i numerosi peptidi del latte identificati come antipertensivi in vitro si sono finora dimostrati clinicamente efficaci negli studi sugli animali e sull’uomo, come recensito in articoli recenti [42, 68, 117, 144]. Nella maggior parte degli studi condotti sull’uomo è stata osservata una diminuzione moderata o significativa della pressione sanguigna dopo il consumo di specifici idrolizzati di proteine del latte o di prodotti lattiero-caseari fermentati. In questi studi sono state registrate diminuzioni di 1.5-14.0 mmHg per la pressione sanguigna sistolica (SBP) e da 0.5 a 6.8 mmHg per la pressione diastolica (DBP), rispetto al placebo. I prodotti in commercio più studiati contengono i due tripeptidi ACE-inibitori VPP e IPP, e vengono venduti rispettivamente con i marchi Calpis ed Evolus. Il prodotto giapponese Calpis è fermentato con una coltura contenente L. helveticus e S. cerevisiae [159] e il prodotto finlandese Evolus è realizzato utilizzando un ceppo L. helveticus LBK-16 H nella fermentazione del latte [148]. Oltre alla diminuzione della pressione arteriosa mediante l’inibizione del sistema renina-angiotensina, recenti studi clinici suggeriscono che questi prodotti sono in grado di migliorare la funzionalità vascolare dei soggetti ipertesi riducendo anche la rigidità arteriosa [66, 69]. I potenziali effetti sulla salute dei CCP sono stati analizzati in molti studi condotti su modelli animali e umani (Meisel e FitzGerald, [103]). A causa dei risultati contrastanti ottenuti in questi studi, resta da stabilire il ruolo dei CPP nel miglioramento della biodisponibilità del calcio nell’organismo. Invece, l’effetto anti-cariogeno dei CPP è stato ben documentato e in alcuni paesi sono stati lanciati sul mercato vari prodotti per la cura dei denti contenenti CPP [137]. Yamauchi [175] ha riportato che due peptidi derivati dall’albumina sierica e dalla β-lattoglobulina erano in grado di indurre la contrazione del muscolo longitudinale dell’ileo di cavia quando il test è stato completato senza stimolazione elettrica in assenza di agonista. I peptidi erano indicati come peptidi in grado di agire sulla muscolatura liscia e contenevano albumina sierica f208-f216 (albutensina A) e β-lattoglobulina f146-f149 (β-lattotensina). La β-lattotensina è stata rilasciata durante l’idrolisi con chimotripsina ed ha avuto un effetto di contrazione non oppioide sulla muscolatura liscia della cavia [132]. Alcuni dei peptidi derivati dalle proteine del latte hanno più di un significato funzionale: i peptidi della sequenza 60-70 della β-caseina mostrano attività immunostimolanti, oppioidi e ACE-inibenti. Tale sequenza è definita come zona strategica [110]. Questa sequenza è protetta dalla proteolisi a causa della sua elevata idrofobicità e della presenza di residui di prolina. In aggiunta alla zona strategica, dalle proteine del latte possono essere liberati altri peptidi multifunzionali, ad esempio αs1-caseina f194-f199 e β-caseina f177-f183 hanno attività immunomodulante e ACE-inibente. Anche dalle proteine del siero di latte possono essere liberati peptidi multifunzionali, ad es. la β-lattoglobulina f102-f105 (β-lattorfina) mostra sia attività ACE-inibente che oppioide.
Possibile importanza fisiologica
I peptidi bioattivi sono ampiamente distribuiti tra le proteine del latte. Questo fatto suggerisce l’importanza fisiologica di questi peptidi. Sebbene la potenza di questi peptidi derivati dal latte sia inferiore a quella dei peptidi endogeni o dei farmaci a base di peptidi, possono avere effetti fisiologici, poiché le proteine del latte vengono solitamente ingerite in quantità piuttosto elevate. Per poter esercitare effetti fisiologici in vivo, i peptidi bioattivi devono essere rilasciati durante la digestione enterica e quindi raggiungere i loro siti bersaglio sul lato luminale del tratto intestinale o, dopo il riassorbimento, sugli organi periferici (Fig.1). Molti studi hanno mostrato la formazione in vitro dei peptidi bioattivi mentre in altri è stata riscontrata anche la formazione in vivo. Oltre alla liberazione durante la digestione in vitro o in vivo, i peptidi bioattivi possono essere liberati anche durante la produzione di latticini (Fig. 2). Ad esempio, le proteine del latte idrolizzate utilizzate per le formulazioni artificiali ipoallergeniche destinate ai lattanti, per applicazioni cliniche e come ingredienti per gli alimenti, contengono esclusivamente peptidi. La proteolisi durante la fermentazione del latte e la maturazione del formaggio porta alla formazione di vari peptidi. Infatti, casomorfine, peptidi ACE-inibitori e fosfopeptidi sono stati riscontrati nei prodotti lattiero-caseari fermentati. Esistono diversi possibili siti bersaglio intestinali e periferici del principio attivo (Fig. 3). Come ligandi dei recettori degli oppioidi, ci potremmo aspettare che questi peptidi si comportino come altri oppioidi, cioè che agiscano come agonisti o antagonisti, che si leghino ai recettori e che suscitino effetti su tutte le cellule o i tessuti in cui è noto che gli oppioidi esercitino la loro azione, veicolati da vie di trasduzione del segnale come già noto per gli oppioidi.
Figura 1. Funzioni fisiologiche dei peptidi derivati dal latte
Evidenze indirette suggeriscono la presenza di β-casomorfine nell’intestino umano dopo l’ingestione di latte [158], mentre i peptidi oppioidi derivati dal latte non sembrerebbero permeare nel letto cardiovascolare, se non in quantità più che trascurabili, nei mammiferi adulti. La degradazione enzimatica dei peptidi nella parete intestinale e nel sangue sembrerebbe evitata. Sembra probabile che le casomorfine partecipino al controllo della funzionalità gastrointestinale negli adulti [163]. È stato scoperto che le casomorfine prolungano il tempo di transito gastrointestinale ed esercitano un’azione antidiarroica [30]. Il significato fisiologico dei peptidi oppioidi può essere diverso nelle donne in gravidanza, in età puerperale e nei neonati. Materiali immunoreattivi della β-casomorfina, che rappresentano ovviamente prodotti di scissione della β-caseina più grandi delle β-casomorfine (cioè potenziali precursori della β-casomorfina) sono stati ritrovati nel plasma e nel compartimento cardiovascolare delle donne durante la gravidanza e l’allattamento e negli animali appena nati [161]. Questi risultati indicano l’attività farmacologica delle β-casomorfine non per importanza fisiologica. L’inibizione dell’ACE, che si ritrova in diversi tessuti (ad esempio plasma, polmone, rene, cuore, muscolo scheletrico, cervello, pancreas) può influenzare diversi sistemi regolatori [123].
Figura 2 Illustrazioni delle molteplici funzioni delle proteine del latte utili per l’attribuzione dei compiti
Quando i peptidi ACE-inibitori (Val-Pro-Pro e Ile-Pro-Pro) sono stati somministrati a ratti spontaneamente ipertesi, la pressione sanguigna si è ridotta in base alla dose. La miscela di peptidi, o il latte fermentato contenente i peptidi, non hanno modificato la pressione sanguigna [120]. Masuda et al. [98] hanno rilevato due tripeptidi ACE-inibitori, presenti nel prodotto a base di latte fermentato, nell’aorta di ratti spontaneamente ipertesi dopo somministrazione orale di latte fermentato. Anche l’attività dell’ACE nelle frazioni aortiche era minore nei ratti a cui era stato somministrato latte fermentato rispetto al gruppo di controllo. I risultati indicano che questi tripeptidi vengono assorbiti direttamente senza essere scomposti dagli enzimi digestivi, raggiungono l’aorta addominale, inibiscono l’ACE ed esercitano attività antipertensiva. È stato dimostrato che i caseinofosfopeptidi hanno proprietà anti-cariogene, basate sulla loro capacità di localizzare il fosfato amorfo nella placca dentale [136]. Residui di caseinofosfopeptidi sono stati isolati nel contenuto intestinale di maiali e ratti alimentati con caseina, indicando la formazione in vivo. La maggior parte dei minerali si scinde dal cibo, a causa del basso pH presente nello stomaco, per poi trasferirsi nel duodeno. Questi ioni possono diventare gradualmente insolubili all’aumentare del pH. Quando sono presenti fosfopeptidi, gli ioni metallici possono essere trattenuti in complessi solubili invece di precipitare con altri composti, rendendoli quindi più assorbibili [143]. Vi è tuttavia, una notevole controversia sul significato fisiologico del potenziamento dell’assorbimento paracellulare del calcio intestinale da parte del caseinfosfopeptide. Il disaccordo è incentrato sulle conclusioni tratte dai vari metodi sperimentali utilizzati per valutare la biodisponibilità del calcio in vivo, che possono comportare diverse misurazioni dell’endpoint. I disaccordi sono in parte dovuti anche alle diverse composizioni dei preparati di fosfopeptidi utilizzati negli studi, che potrebbero portare a diverse attività di legame del calcio, come dimostrato da Meisel et al. [102].
Figura 3 Schema fisiologico della bioattività dei peptidi del siero di latte
(Fonte: Madureira, A., R., Tavares, T., Gomes, M., P., Malcata F., X., 2010, “Physiological Properties of Bioactive Peptides Obtain from Whey Proteins”, J. Dairy Science, 93, 437-455)
I peptidi con attività biologica potrebbero essere prodotti in diversi modi. I metodi più comuni sono: trasformazione degli alimenti mediante calore, condizioni alcaline o acide che idrolizzano le proteine, idrolisi enzimatica delle proteine alimentari e attività microbica negli alimenti fermentati. Sebbene i peptidi bioattivi esistano in un certo numero di alimenti trasformati e fermentati, le loro vere funzioni fisiologiche nell’uomo sono ancora sconosciute. In individui sani, che seguono una dieta varia, la presenza di peptidi bioattivi può aiutare a mantenere in buono stato il sistema nervoso, il sistema immunitario e il sistema digerente. Il potenziale valore futuro dei peptidi bioattivi nella dieta potrebbe essere legato alla loro capacità di influenzare determinate condizioni patologiche, sebbene ciò debba ancora essere dimostrato. I peptidi derivati dalla caseina hanno già trovato interessanti applicazioni come integratori alimentari (fosfopeptidi) e come preparazioni farmaceutiche (fosfopeptidi, β-casomorfine) [15, 136]. L’efficacia e le condizioni di utilizzo sicure di questi peptidi negli animali e nell’uomo devono ancora essere dimostrate. Attualmente, i peptidi ACE-inibitori e i fosfo-peptidi rappresentano un’area importante all’interno della quale i peptidi bioattivi possono essere definiti come utili ingredienti per applicazioni dietetiche. I peptidi derivati dal latte possono legare una varietà di molecole e ioni in base ai loro siti specifici. Le caseine derivate dai bovini, come la α e la β, hanno affinità di legame con il calcio, così come con le nanoparticelle di fosfato di calcio mediante i loro residui di serina-fosfato [48]. La funzione di base della lattoferrina è quella di legare e trasportare lo ione ferrico, ma in vivo può anche legare altri ioni metallici come rame, cromo, manganese e alluminio. Guilloteau et al. [55] hanno stabilito che l’inibizione delle secrezioni gastriche appariva più importante quando i fosfopeptidi (PP) venivano somministrati in associazione con il caseinomacropeptide (CMP) nella dieta piuttosto che da soli. Il CMP e i fosfopeptidi (PP) possono avere, rispettivamente, un’azione a breve e a lungo termine nell’arco delle 24 ore giornaliere. Secondo la nostra conoscenza, è la prima volta che viene dimostrato che i fosfopeptidi provenienti dalla digestione della caseina del latte inibiscono la secrezione gastrica. Il co-legame di un anione bicarbonato è essenziale per il legame degli ioni metallici [48]. La funzione della α-la è di regolazione della sintesi del lattosio. Ha anche un’affinità naturale nel legarsi al calcio [48] quindi, oltre alla somministrazione di calcio, potrebbe essere potenzialmente utilizzata per questo scopo nei regimi alimentari. Le proteine del latte si legano alle molecole idrofobe utilizzando diversi meccanismi; fondamentalmente utilizzano interazioni idrofobiche, forze di Vander Waals e legami a idrogeno (Fig. 2).
Shrikant Sharma1,2*, Raghvendar Singh1, Shashank Rana2
1Bioinformatics Facility, Department of Immunology, College of Biotechnology, Sardar Vallabh Bhai Patel University of Agriculture & Technology Meerut (U.P.), India
E-mail Dr. Raghvendar Singh: Raghvendar@gmail.com
2School of Life Science, Singhania University Jhunjhunu (R.J.), India
E-mails: shribioinfo@gmail.com (Shrikant Sharma), Shashank.bioinfo@gmail.com (Shashank Rana)
*Corresponding author
Ringraziamenti
Siamo molto grati ad Anne Pihlanto-Leppälä e collaboratori dell’Agricultural Research Centre of Finland, Food Research Institute, FIN 31600 Jokioinen, Finlandia, per il loro aiuto e il coordinamento nella preparazione di questa review.
S
Ho il piacere di ringraziare tutti coloro i cui articoli sono stati consultati per preparare questa review.
Riferimenti
- Addeo, F., Chianese, L., Salzano, A., Sacchi, F., Cappuccio, U., Ferranti, P. and Malorni, A., (1992). Characterization of the 12% trichloroacetic acid-insoluble oligopeptides of Parmigiano-Reggiano cheese. Journal of Dairy Research, 59, 401-411.
- Adibi, S. A. and Kim, Y.S. (1981). In physiology of gastrointestinal tract. Raven Press, New York, 1097-1122.
- Agyeia, D. and Danquah, M. K. (2011). Industrial-scale manufacturing of pharmaceutical-grade bioactive peptides. Biotechnology Advances, 29, 272-277.
- Antila, P., Paakkari, I., Järvinen, A., Mattila, M.J., Laukka nen, M., Pihlanto-Leppälä, A., Mäntsälä, P. and Hellman, J. (1991). Opioid peptides derived from in vitro proteolysis of bovine whey proteins. International Dairy Journal, 1, 215-229.
- Baba, T. and Schneewind, O. (1998). Instruments of microbial warfare bacteriocin synthesis, toxicity and immunity. Trends in Microbiology, 6, 66-71.
- Berrocal, R., Chanton, S., Juilleart, M.A., Pavillard, B., Scherz, J. C. and Jost, R. (1989). Tryptic phosphopeptides from whole casein. II Physicochemical properties related to the solubilization of calcium. Journal of Dairy Research, 56, 335-341.
- Bellamy, W., Takase, M., Wakabayashi, H., Kawase, K. and Tomita, M. (1992). Antibacterial spectrum of lactoferricin B, a potent bactericidal peptide derived from the N-terminal region of bovine lactoferrin. Journal of Applied Bacteriology, 73(6), 472-479.
- Benson, D. A., Karsch-Mizrachi, I., Lipman, D. J., Ostell, J., Rapp, B. A., and Wheeler, D.L. (2002). GenBank. Nucleic Acids Res., 30(1), 17-20.
- Bernard, H. Meisel, H., Creminon, C. and Wal, J. M. (2000). Post-translational phosphorylation affects the IgE binding capacity of caseins. FEBS Letters, 467, 239-244.
- Bairoch, A., and Apweiler, R. (2000). The SWISS-PROT protein sequence database and its supplement TrEMBL in 2000. Nucleic Acids Res., 28(1), 45-48
- Blythe, M. J., Doytchinova, I. A. and Flower, D.R. (2002). JenPep: a database of quantitative functional peptide data for immunology. Bioinformatics, 18(3), 434-439.
- Brandsch, M., Brust, P., Neubert, K. and Ermisch, A. (1994). p-casomorphins-chemical signals of intestinal transport systems. In: Brantl, V., Teschemacher, H. (Eds.), β-casomorphins and related peptides: recent developments. VCH, Weinheim, 207-219.
- Brantl, V., Teschemacher, H., Henschen, A. and Lottspeich, F. (1979). Novel opioid peptides derived from casein (-casomorphins) Isolation from bovine casein pepton. Hoppe-Seyler’s Z. Physiol. Chem., 360, 1211-1216.
- Bulet, P. and Stocklin, R. (2005). Insect antimicrobial peptides structures, properties and gene regulation. Protein Peptide Letter, 12, 3-11.
- Brulé, G., Roger, L., Fauquant, J. and Piot, M. 1982. Phosphopeptides from casein derived material. U.S. Patent 4, 358, 465.
- Bush, K. (2004). Antibacterial drug discovery in the 21st century. Clinical Microbiology Infection, 10, 10-17.
- Calder P. C. (1994) Glutamine and the immune system. Clinical Nutrition, 13, 2-8.
- Chabance, B., Jollés, P., Izquierdo, C., Mazoyer, E., Francoual, C., Drouet, L. and Fiat, A. M. (1995). Characterization of an antithrombotic peptide from kappa-casein in newborn plasma after milk ingestion. British Journal of Nutrition, 73, 583-590.
- Chang, K. J., Fu. Su, Y., Brent, D. A. and Chang, J. K. (1985). Isolation of a specific m-opiate receptor peptide, morphiceptin, from an enzymatic digest of milk proteins. Journal of Biology and Chemistry, 260, 17, 9706-9712.
- Charpentier S., Amiche M., Mester J., Vouille V., Le Caer J.P., Nicolas P., and Delfour A. (1998). Structure, synthesis, and molecular cloning of dermaseptins B, a family of skin peptide antibiotics. J Biol Chem., 273(24), 14690-14697.
- Cheung, H. S., Wang, F. L., Ondetti, M. A., Sabo, E. F. and Cushman, D.W. (1980). Binding of peptide substrate and inhibitors of angiotensin-convering enzyme. Journal of Biology and Chemistry, 2, 401-407.
- Chiba, H., Tani F. and Yoshikawa, M. (1989). Opioid antagonist peptides derived from β-casein. Journal of Dairy Research, 56, 363-366
- Chiu, S. C. K. and Kitts, D. D. (2004). Antioxidant characterization of caseinphosphopeptides from bovine milk. In: F. Shahidi, and D. K. Weerasinghe (Eds.), Nutraceutical beverages: chemistry, nutrition and health effects. Series A ACS symposium series, 871, 279-289.
- Cho, S. S., Lee, H. K., Yu, C. Y., Kim, M. J., Seong, E. S., Ghimire, B. K., Son, E. H., Choung, M. G. and Lim, J. D. (2008). Isolation and characterization of bioactive peptides from Hwangtae (yellowish dried Alaska pollack) protein hydrolysate. Journal of Food Science and Nutrition, 13, 196-203.
- Clare, D. A. and Swaisgood, H. E. (2000). Bioactive milk peptides: a prospectus. Journal of Dairy Science, 83, 1187-1195.
- Contreras M. M., Carron R., Montero, M. J., Ramos M. and Recio I. (2009). Novel casein-derived peptides with antihypertensive activity. International Dairy Journal, 19, 566-573.
- Coste, M., Rochet, V., Leonil, J., Molle, D., Bouhallab, S. and Tome, D. (1992). Identification of C-terminal peptides from bovine -casein that enhance proliferation on rat lymphocytes. Immunology Letters, 33, 41-46.
- Csordás L. A. and Michl H. 1969, Primary structure of two oligopeptides of the toxin of Bombina variegate, Toxicon, 7(2), 103-108.
- D’Agata, E. M. (2004). Rapidly rising prevalence of nosocomial multidrug-resistant, Gram-negative bacilli a 9-year surveillance study. Infect. Control Hosp. Epidemiology, 25, 842-846.
- Daniel, H., Vohwinkel, M. and Rehner, G. (1990). Effect of casein and β-casomorphins on gastrointestinal motility in rats. Journal of Nutrition, 120, 252-257.
- Deshpande, L. M., Fritsche, T. R. and Jones, R. N. (2004). Molecular epidemiology of selected multidrug-resistant bacteria a global report from the SENTRY Antimicrobial Surveillance Program. Diagnosis of Microbiology Infections and Disease, 49, 231-236.
- Dellaire G., Farrall R. and Bickmore W. A. (2003). The nuclear protein database (NPD): sub-nuclear localisation and functional annotation of the nuclear proteome. Nucleic Acids Res., 31(1), 328-230.
- Dionysius, D. A. and Milne J. M. (1997). Antibacterial peptides of bovine lactoferrin: purification and characterization, Journal of Dairy Science, 80, 667-674.
- Diaz, M. and Decker, E. A. (2004). Antioxidant mechanisms of caseinophosphopeptides and casein hydrolysates and their application in ground beef. Journal of Agricultural and Food Chemistry, 52, 8208-8213.
- Dionysius, D. A. and Milne, J. M. (1997). Antibacterial peptides of bovine lactoferrin: purification and characterization. J Dairy Sci., 80(4), 667-674.
- Dores, R. M. and Baron A. J. (2011). Evolution of POMC: origin, phylogeny, posttranslational processing and the melanocortins. Trends in Neuroendocrinology, 1220, 34-48.
- Dziuba, J. and Iwaniak, A. (2006). Database of protein and bioactive peptide sequences. In: Nutraceutical proteins and peptides in health and disease. Edited by Mine V, Shahidi F. CRC – Taylor & Francis, Boca Raton, London, 543-563.
- Eads, T. M. (1994). Molecular basis of structure and functionality in foods. Trends Food Science Technology, 5, 147-159.
- Elias, R. J., Bridgewater, J. D., Vachet, R. W., Waraho, T., McClements, D. J. and Decker, E. A. (2006). Antioxidant mechanisms of enzymatic hydrolysates of b-lactoglobulin in food lipid dispersions. Journal of Agricultural and Food Chemistry, 54, 9565-9572.
- Elitsur, Y. and Luke, G.D. (1991). Beta-casomorphin (BCM) and human colonic lamina propria lymphocyte proliferation. Clinical Experimental Immunology, 85, 493-497.
- Epand, R. M. and Vogel, H. J. (1999). Diversity of antimicrobial peptides and their mechanisms of action. Biochem. Biophys. Acta, 1462, 11-28.
- Erdman, K., Cheung, B. W. Y. and Schroder, H. (2008). The possible role of foodderived bioactive peptides in reducing the risk of cardiovascular disease. Journal of Nutritional Biochemistry, 19, 643-654.
- Fiat, A. M., Levy-Toledano, S., Caen, J. P. and Jollés, P. (1989). Biologically active peptides of casein and lactotransferrin implicated in platelet function. J. Dairy Res., 56, 351-355.
- Fernandez-de, C. R., Gonzalez-Pascual, B., Garcia-Olmedo, F. and Carbonero, P. (1972). Susceptibility of phytopathogenic bacteria to wheat purothionins in vitro. Applied Microbiology, 23, 998-1000.
- FitzGerald, R. J., Murray, B. A., and Walsh, D. J. (2004). Hypotensive peptides from milk proteins. Journal of Nutrition, 134, 980S-988S.
- FitzGerald R. and Murray B.A. (2006). Bioactive peptides and lactic fermentations. International Journal of Dairy Technology, 59, 118-125.
- FitzGerald, R. J. and Meisel, H. M. (2003). Milk protein hydrolysis and bioactive peptides. In: Advanced dairy chemistry, Third Edition, Part B, Chapter 14 (Eds. Fox, P. F. and McSweeney, P.), Kluwer Academic/Plenum Publishers, New York, 675-698.
- Fox, P., F. and McSweeney, P., L., H. (2003). Advanced Dairy Chemistry, Proteins Part A. Kluwer Academic/Plenum Publishers, 1, 3.
- Gagnaire, V., Pierre, A., Molle, D. and Leonil, J. (1996). Phosphopeptides interacting with colloidal calcium phosphate isolated by tryptic hydrolysis of bovine casein micelles. J. Dairy Res., 63, 405-422.
- Ganz, T., M. E. Selsted, D. Szklarek, S. S. Harwig, K. Daher, D. F. Bainton and R. I. Lehrer. (1985) Defensins. Natural peptide antibiotics of human neutrophils. J Clin Invest., 76(4), 1427-1435
- Ganz, T. (2003) Defensins: antimicrobial peptides of innate immunity, Nature Reviews Immunology, 3, 710-720.
- Garcia-Olmedo, F., Molina, A., Alamillo, J. M. and Rodriguez-Palenzuela, P. (1998). Plant defense peptides. Biopolymers, 47, 479-491.
- George, D. G., Dodson, R. J., Garavelli, J. S., Haft, D. H., Hunt, L. T., Marzec, C. R., Orcutt, B. C., Sidman, K. E., Srinivasarao, G. Y., Yeh, L. S. L., Arminski, L. M., Ledley, R. S., Tsugita A. and Barker, W. C. (1997). The protein information resource (PIR) and PIR-international protein sequence database. Nucleic Acids Research, 25, 24-27.
- Gill, H. (2003). Dairy products and the immune function in the elderly. In: Functional dairy products, Mattila-Sandholm, T., Saarela, M.; Eds.; CRC, Washington DC, 133-167.
- Guilloteau P., Romé V., Delaby L., Mendy F., Roger L., and Chayvialle J. A. (2009). A new role of phosphopeptides as bioactive peptides released during milk casein digestion in the young mammal: regulation of gastric secretion. Peptides, 30(12), 2221-2227.
- Habermann G., (1972). The aging larynx: functional aspects. HNO, 20(4), 121-124.
- Hancock, R. E. (2001). Cationic peptides effectors in innate immunity and novel antimicrobials, Lancet Infect. Dis., 1, 156-164.
- Haiwara, H., Hiruma, Y., Inoue, A., Yamaguchi, A. and Hirose, S. (1998). Deceleration by angiotensin II of differentiation and bone formation of rat calvarial osteoblastic cells. Journal of Endocrinology, 156, 543-550.
- Haque, E., Chand, R. and Kapila, S. (2009). Biofunctional properties of bioactive peptides of milk origin. Food Reviews International, 25, 1, 28-43.
- Hartman, O., Zhangb, C., Adams, E. L., Mary, C., Carson, F., Petrelli, N., J., Chasea B. D. and Rabolta, J. F. (2010). Biofunctionalization of electrospun PCL-based scaffolds with perlecan domain IV peptide to create a 3-D pharmacokinetic cancer model. Biomaterials, 31, 5700-5718.
- Hashimoto, Y., Tanaka, M., Hata, A., Kakuta, T., Maruyama, Y. and Numano, F. (1996). Four years follow-up study in patients with Takayasu arteritis and severe aortic regurgitation; assessment by echocardiography. International Journal Cardiology, 1996, 54, S173-S176.
- Hata, I., Ueda, J. and Otani, H. (1999). Immunostimulatory action of a commercially available casein phosphopeptides preparation, CPP-III, in cell cultures, Milchwissenschaft, 54, 3-7.
- Hatton, R., Stimpel, M. and Chambers, T.J. (1997). Angiotensin II is generated from angiotensin I by bone cells and stimulates osteoclastic bone resorption in vitro. Journal of Endocrinology, 152, 5-10.
- Higgins, R.D., Yan, Y., Geng, Y., Shara, J. and Barr, S. M. (2003) Captopril and vascular endothelial growth factor in a mouse model of retinopathy. Curr. Eye. Res., 27, 123-129.
- Hollt, V. (1983). Multiple endogenous opioid peptide. Trends Neuroscience, 6, 24-26.
- Hirota, T., Ohki, K., Kawagishi, R., Kajimoto, Y., Mizuno, S., Nakamura, Y., and Kitakaze, M. (2007) Casein hydrolysate containing the antihypertensive tripeptides Val-Pro-Pro and Ile-Pro-Proimproves vascular endothelial function independent of blood pressure-lowering effects: contribution of the inhibitory action of angiotensinconverting enzyme. Hypertens. Res. 2007, 30, 489-496.
- Jakala P. and Vapaatalo H. (2010). Antihypertensive peptides from milk proteins. Pharmaceuticals, 3, 251-272.
- Jauhiainen, T. and Korpela, R. (2007). Milk peptides and blood pressure. Journal of Nutrition, 137, 825S-829S.
- Jauhiainen, T., Wuolle, K., Vapaatalo, H., Kerojoki, O., Nurmela, K., Lowrie, C. and Korpela, R. (2007). Oral absorption, tissue distribution and excretion of a radio labelled analog of a milk derived antihypertensive peptide, Ile-Pro-Pro, in rats. International Dairy Journal, 17, 1216-1223.
- Jenssen, H., Hamill, P. and Hancock, R. E. (2006). Peptide antimicrobial agents. Clinical Microbiology, 19, 491-511.
- Jing, H. and Kitts, D. D. (2004). Redox-related cytotoxic responses to different casein glycation products in Caco-2 and Int-407 cells. Journal of Agricultural and Food Chemistry, 52, 3577-3582.
- Jollés, P. and Caen, J.P. (1991). Parallels between milk clotting and blood clotting: opportunities for milk-derived products. Trends in Food Science and Technology, 2, 42-43.
- Jolles, P., Levy-Toledano, S., Fiat, A. M., Soria, C., Gillessen, D., and Thomaidis, A. (1986). Analogy between fibrinogen and casein effect of an undecapeptide isolated from kappa-casein on platelet function. European Journal of Biochemistry, 158, 379-382.
- Jollès, P. and Henschen, A. (1982). Comparison between the clotting of blood and milk. Trends in Biochemical Science, 7, 325-328.
- Juilleart, M. A., Baechler, R., Berrocal, R., Chanton, S., Scherz, J. C. and Jost, R. (1989). Tryptic phosphopeptides from whole casein I. Preparation and analysis by fast protein liquid chromatography. Journal of Dairy Research, 56, 603-611.
- Kamau, S. M., Lu, R. R., Chen, W., Liu, X. M., Tian, F. W., Shen, Y. and Gao, T. (2010). Functional significance of bioactive peptides derived from milk proteins. Food Reviews International, 26, 386-401.
- Kayser, H. and Meisel, H. (1996). Stimulation of human peripheral lymphocytes by bioactive peptides derived from bovine milk proteins. FEBS Letters, 383, 18-20.
- Kim, G. N., Jang, H. D. and Kim, C. I. (2007). Antioxidant capacity of caseinophosphopeptides prepared from sodium caseinate using Alcalase. Food Chemistry, 104, 1359-1365.
- Kitts, D. D. and. Weiler, K. A. (2003). Bioactive proteins and peptides from food sources applications of bioprocesses used in isolation and recovery. Current Pharmaceutical Design, 9, 1309-1323.
- Koh I. Y. Y., V. A. Eyrich, M. A. Marti-Renom, D. Przybylski, M. S. Madhusudhan, N. Eswar, O. Graña, F. Pazos, A. Valencia, A. Sali and B. Rost (2003). EVA: evaluation of protein structure prediction servers. Nucleic Acids Research, 31, 3311-3315.
- Korhonen, H., and Pihlanto-Leppala, A. (2003). Food-derived bioactive peptides: opportunities for designing future foods. Current Pharmaceutical Design, 9, 1297-1308.
- Korhonen, H. (2002). Technology options for new nutritional concepts. International Journal of Dairy Technology, 55, 79-88.
- Kullisaar, T., Songisepp, E, Mikelsaar, M, Zilmer K, Vihalemm, T. and Zilmer, M. (2006). Antioxidative probiotic fermented goats’ milk decreases oxidative stressmediated atherogenicity in human subjects. British Journal of Nutrition, 2, 449-456.
- Laffineur, E., Genetet, N. and Leonil, J. (1996). Immunomodulatory activity of β-casein permeate medium fermented by lactic acid bacteria. Journal of Dairy Science, 79, 2112-2120.
- Lahov, E. and Regelson, W. (1996). Antibacterial and immunostimulating caseinderived substances from milk: casecidin, isracidin peptides. Food Chem. Toxicol., 34, 131-145.
- Lambert, P. A. (2005). Bacterial resistance to antibiotics modified target sites. Advanced Drug Delivery Review, 57, 1471-1485.
- Laparra, J. M., Alegrıa, A., Barbera, R. and Farre, R. (2008). Antioxidant effect of casein phosphopeptides compared with fruit beverages supplemented with skimmed milk against H2O2-induced oxidative stress in Caco-2 cells. Food Research International, 41, 773-779.
- Li, X. Z. and Nikaido, H. (2004). Efflux-mediated drug resistance in bacteria, Drugs, 64, 159-204.
- Livney, Y D. (2010). Milk proteins as vehicles for bioactives. Current Opinion in Colloid and Interface Science, 15, 73-83.
- Lopez-Exposito, I. and Recio, I. (2008). Protective effect of milk peptides: antibacterial and antitumor properties. Advances in Experimental Medicine and Biology, 606, 271-293.
- Lòpez-Expòsito, I., and Recio, I., (2006). Antibacterial activity of peptides and folding variants from milk proteins. Int. Dairy J., 16, 1294-1305.
- Lopez-Fandino, R., Otte, J., and Van Camp, J. (2006). Physiological, chemical and technological aspects of milk-protein-derived peptides with antihypertensive and ACE-inhibitory activity. International Dairy Journal, 16, 1277-1293.
- Loukas, S., Varoucha, D., Zioudrou, C., Streaty, R. and Klee, W. A. (1983). Opioid activities and structures of -casein derived exorphins. Biochemistry, 22, 4567-4573.
- Maeno, M., Yamamoto, N. and Takano, T. (1996). Identification of antihypertensive peptides from casein hydrolysate produced by a proteinase from Lactobacillus helveticus CP790. Journal of Dairy Science, 73, 1316-1321.
- Maruyama, S. and Suzuki, H. (1982). A peptide inhibitor of angiotensin I-convertign enzyme in the tryptic hydrolysate of casein. Agricultural and Biological Chemistry, 46(5), 1393-1394.
- Maruyama, S., Nakagomi, K., Tomizuka, N. and Suzuki, H. (1985). Angiotensin I-converting enzyme inhibitor derived from an enzymatic hydrolysate of casein. II. Isolation and bradykinin-potentiating activity on the uterus and the ileum of rats. Agricultural and Biological Chemistry, 49(5), 1405-1409.
- Maruyama, S., Mitachi, H., Awaya, J., Kurono, M., Tomizuka, N. and Suzuki, H. (1987). Angiotensin I-converting enzyme inhibitory activity of the C-terminal hexapeptide of as1-casein. Agricultural and Biological Chemistry, 51, 2557-2561.
- Masuda, O., Nakamura, Y. and Takano, T. (1996). Antihypertensive peptides are present in aorta after oral administration of sour milk containing these peptides to spontaneously hypertensive rats. Journal of Nutrition, 126, 3063-3068.
- Matar, C., LeBlanc, J. G., Martin, L. and Perdigon, G. (2003). Biologically active peptides released in fermented milk: role and functions. In: E. R. Farnworth, (Ed.), Handbook of fermented functional foods. Functional foods and nutraceuticals series, 177-201.
- Meisel, H. and Frister, H. (1988). Isolation and characterization of a phosphopeptide from in vivo digests of casein in milk proteins. Nutritional, chemical, functional and technological aspects, Eds., C.A. Barth and E. Schlimme, Darmstadt Steinkopf Verlag, 150-154.
- Meisel, H. (1986). Chemical characterization and opioid activity of an exorphin isolated from in vivo digests of casein. FEBS Letters, 196, 223-227.
- Meisel, H., Behrens, S. and Schlimme, E. (1991). Calcium-bindungsstudien an phosphopeptidfraktionen aus der in vitro-proteolyse von casein. Kieler Milchwirt schaft liche for schungs berichte, 43(3), 199-212.
- Meisel, H., Goepfert, A. and Gunther, S. (1997). ACE-inhibitory activities in milk products. Milchwissenschaft, 52(6), 307-311.
- Meisel, H. and FitzGerald, R. J. (2000). Opioid peptides encrypted in intact milk protein sequences. British Journal of Nutrition, 84, 27-31.
- Meisel, H. and FitzGerald, R. J. (2003). Biofunctional peptides from milk proteins: mineral binding and cytomodulatory effects. Current Pharmaceutical Design, 9, 1289-1295.
- Meisel, H. and Schlimme, E. (1994). Inhibitors of angiotensin converting enzyme derived from bovine casein (casokinins), In: -casomorphins and related peptides: recent developments, Eds., V. Brantl and H. Teschemacher, Weinheim, New York, VCH, 27-33.
- Meisel, E. (1993). Diagnosis and clinical aspects of supraventricular tachycardia. Z Gesamte Innate Medicine, 48(9), 414-424.
- Melo, F. and Feytmans, E. (1998). Assessing protein structures with anon-local atomic interaction energy. Journal of Molecular Biology, 277, 1141-1152.
- Migliore-Samour, D., Floc’h, F. and Jollés, P. (1989). Biologically active casein peptides implicated in immunomodulation. J. Dairy Res., 56, 357-362.
- Migliore-Samour, D. and Jollés, P. (1988). Casein, a prohormone with an immunomodulating role for the newborn?, Experientia, 44, 188-193.
- Mizushima, S., Ohshige, K., Watanabe, J., Kimura, M., Kadowaki, T., Nakamura, Y., Tochikubo, O. and Ueshima, H. (2004). Randomized controlled trial of sour milk on blood pressure in borderline hypertensive men. American Journal of Hypertension, 17, 701-706.
- Mizuno S., Nishimura, S., Matsuura, K., Gotou, T. and Yamamoto, N. (2004). Release of short and proline rich antihypertensive peptides from casein hydrolyzate with an Aspergillus oryzae protease. J Dairy Sci 87, 3183-3188.
- Mock, W. L., Green, P. C. and Boyer, K. D. (1990). Specificity and pH dependence for acylproline cleavage by prolidase. Journal of Biology and Chemistry, 265(19), 600-619.
- Mor A., Delfour A., and Nicolas P. (1991). Identification of a D-alanine-containing polypeptide precursor for the peptide opioid, dermorphin. J Biol Chem., 266(10), 6264-6270.
- Mullally, M. M., Meisel, H. and FitzGerald, R. J. (1997). Identification of a novel angiotensin-I-converting enzyme inhibitory peptide corresponding to a tryptic fragment of bovine beta-lactoglobulin. FEBS Letters, 402, 99-101.
- Murakami M., Tonouchi H., Takahashi R., Kitazawa H., Kawai Y., Negishi H. and Saito T. (2004). Structural analysis of a new anti-hypertensive peptide (-lactosin B) isolated from a commercial whey product. Journal of Dairy Science, 87(7), 1967-1974.
- Murray, B. A. and FitzGerald, R. J. (2007). Angiotensin converting enzyme inhibitory peptides derived from food proteins: biochemistry, bioactivity and production. Current Pharmaceutical Design, 13, 773-791.
- Naitza S. and Ligoxygakis P. (2004). Antimicrobial defences in Drosophila: the story so far. Mol Immunol., 40(12), 887-896.
- Nakai, S. and Alizadeh-Pasdar, N. (2006). Rational designing of bioactive peptides. Nutraceutical proteins and peptides in health and disease, Edited by Mine V., Shahidi F., Taylor & Francis, 565-582.
- Nakamura, Y., Yamamoto, N., Sakai, K., Okubo, A., Yamazaki, S. and Takano, T. (1995). Purification and chracterization of angiotensin I-converting enzyme inhibitors from sour milk. Journal of Dairy Science, 78, 777-783.
- Nascimento A. C., Fontes W., Sebben A., and Castro M. S. (2003). Antimicrobial peptides from anurans skin secretions. Protein Pept Lett., 10(3), 227-238.
- Notredame, C., Higgens, D. and Heringa, J. (2000). T-Coffee: a novel method for fast and accurate multiple sequence alignment. Journal of Molecular Biology, 302, 205-217.
- Ondetti, M. A. and Cushman, D.W. (1984). Angiotensin-converting enzyme inhibitors Biochemical properties and biological actions. CRC Critical Review of Biochemistry, 16, 381-411.
- Ovadia, O., Linde, Y., Haskell, L. C., Dirain, M. L., Sheynis, T. and Jelinek, R. (2010). The effect of backbone cyclization on PK/PD properties of bioactive peptide-peptoid hybrids: the melanocortin agonist paradigm. Bioorganic and Medicinal Chemistry, 18, 580-589.
- Paakkari, I., Järvinen, A., Antila, P., Mattila, M. J. and Pihlanto-Leppälä, A. (1994). Opioid effects of the milk whey-protein derived peptides – and -lactorphin. In: -casomorphins and related peptides, recent development, 33-37.
- Pagelow, I. and Werner, H. (1986). Immunomodulation by some oligopeptides. Methodology and Finding Experimental Clinical Pharmacology, 8(2), 91-95.
- Pal, S. and Ellis, V. (2010). The chronic effects of whey proteins on blood pressure, vascular function, and inflammatory markers in overweight individuals. Obesity, 18(7), 1354-1359.
- Parker, F., Migliore-Samour, D., Floc’h, F., Zerial, A., Werner, G. H., Jollés, J., Casaretto, M., Zahn, H. and Jollés, P. (1984). Immunostimulating hexapeptide from human casein amino acid sequence, synthesis and biological properties. European Journal of Biochemistry, 145, 677-682.
- Perez-Castrillon, J. L., Justo, I., Silva, J., Sanz, A., Martin-Escudero, J. C., Igea R., Escudero, P., Pueyo, C., Diaz, C., Hernandez G. and Duenas, A. (2003). Relationship between bone mineral density and angiotensin converting enzyme polymorphism in hypertensive postmenopausal women. American Journal Hypertension, 16, 233-235.
- Phelan, M., Aherne, A., FitzGerald, R. J. and O’Brien, N. M. (2009). Casein-derived bioactive peptides: biological effects, industrial uses, safety aspects and regulatory status. International Dairy Journal, 19, 643-654.
- Pihlanto-Leppälä, A., Antila, P., Mäntsälä, P. and Hellman, J. (1994). Opioid peptides produced by in vitro proteolysis of bovine caseins. International Dairy Journal, 4, 281-301.
- Pihlanto-Leppälä, A., Paakkari, I., Rinta-Koski, M. and Antila, P. (1997). Bioactive peptide derived from in vitro proteolysis of bovine b-lactoglobulin and its effect on smooth muscle. Journal of Dairy Research, 64, 149-155.
- Pihlanto-Leppälä, A. (2001). Bioactive peptides derived from bovine whey proteins: opioid and ace-inhibitory peptides. Trends in Food Science & Technology, 11(9-10), 347-356.
- Poole, K., Russell, A. D. and Lambert, P. A. (2005). Mechanisms of antimicrobial resistance opportunities for new targeted therapies. Advanced Drug Delivery Review, 57, 443-1445.
- Pouliot, Y., Gauthier, S. F. and Groleau, P. E. (2006). Membrane-based fractionation and purification strategies for bioactive peptides. In: Y. Mine and F. Shahidi (Eds.). Nutraceutical proteins and peptides in health and disease nutraceutical science and technology, 4, 639-658.
- Reynolds, E. C. (1994). Antigariogenic casein phosphopeptide, 24th International Dairy Congress, Melbourne Australia, 18-22.
- Reynolds, E. C. (2003). Dairy components in oral health. Australian Journal of Dairy Technology, 58, 79-81.
- Rival, S. G., Boeriu, C., G. and Wichers, H. J. (2001). Caseins and casein hydrolysates. 2. Antioxidative properties and relevance to lipoxygenase inhibition. Journal of Agriculture Food Chemistry, 49, 295-302.
- Rokka, T., Syväoja, E., L., Tuominen, J. and Korhonen, H. (1997). Release of bioactive peptides by enzymatic proteolysis of Lactobacillus GG fermented UHT-milk. Milchwissenschaft, 52, 307-311.
- Roudot Sato, R., Noguchi, T. and Naito, H. (1986). Casein phosphopeptide (CPP) enhances calcium absorption from the ligated segment of rat small intestine. Journal of Nutrition Science and Vitaminology, 32, 67-76.
- Roudot-Algaron, F., LeBars, D., Kerhoas, L., Einhorn, J. and Gripon, J. C. (1994). Phosphopeptides from Comté cheese: nature and origin. Journal of Food Science. Food Sci., 59, 544-550.
- Sakanaka, S., Tachibana, Y., Ishihara, N. and Juneja, L. R. (2005). Antioxidant properties of casein calcium peptides and their effects on lipid oxidation in beef homogenates. Journal of Agricultural and Food Chemistry, 53, 464-468.
- Sato, R., Noguchi, T. and Naito, H. (1986). Casein phosphopeptide (CPP) enhances calcium absorption from the ligated segment of rat small intestine. Journal of Nutrition Science and Vitaminology, 32, 67-76.
- Saito, T. (2008). Antihypertensive peptides derived from bovine casein and whey proteins. In: Z. Bösze (Ed.). Advances in experimental medicine and biology: Bioactive components of milk, 606, 295-317.
- Schlimme, E. and Meisel H. (1995). Bioactive peptides derived from milk proteins: structural, physiological and analytical aspects. Die Nahrung, 39, 1-20.
- Schwede, T., Kopp, J., Guex, N. and Peitsch, M. C. (2003). SWISS-MODEL: an automated protein homology-modeling server. Nucleic Acids Research, 31, 3381-3385.
- Sekiya, S., Kobayashi, Y., Kita, E., Imamura, Y. and Toyama, S. (1992). Antihypertensive effects of tryptic hydrolysate of casein on normotensive and hypertensive volunteers. Journal of Japanese Society of Nutrition and Food Science, 45, 513-517.
- Seppo, L., Kerojoki, O., Suomalainen, T. and Korpela, R. (2002). The effect of a Lactobacillus helveticus LBK-16 H fermented milk on hypertension – a pilot study on humans. Milchwissenschaft, 57, 124-127.
- Shah, H. (2000). Effects of milk-derived bioactives: an overview. British Journal of Nutrition, 84, 3-10.
- Selsted M. E., and Ouellette A. J. (2006) Mammalian defensins in the antimicrobial immune response. Nat Immunol, 6(6), 551-7.
- Shah, H. (2000). Effects of milk-derived bioactives: an overview. British Journal of Nutrition, 84, 3-10.
- Singh, T. K., Fox, P. F. and Healy, A. (1997). Isolation and identification of further peptides in the diafiltration retentate of water-soluble fraction of Cheddar cheese. Journal of Dairy Research, 64(3), 433-443.
- Sipola, M., Finckenberg, P., Santisteban, J., Korpela, R., Vapaatalo, H., and Nurminen, M., L. (2001). Long-term intake of milk peptides attenuates development of hypertension in spontaneously hypertensive rats. Journal of Physiology and Pharmacology, 52, 745-754.
- Stewart, P. S. and Costerton, J. W. (2001). Antibiotic resistance of bacteria in biofilms. Lancet, 358, 135-138.
- Sturner, R. A., and Chang, K. J., (1998). Opioid peptide content in infant formulas. Pediatr. Res., 23, 4-10.
- Suetsuna, K., Ukeda, H. and Ochi, H. (2000). Isolation and characterisation of free radical scavenging activities peptides derived from casein. Journal of Nutritional Biochemistry, 11, 128-131.
- Sutas, Y., Hurme, M. and Isolauri, E. (1996). Down-regulation of anti-CD3 antibodyinduced IL-4 production by bovine caseins hydrolysed with Lactobacillus GG-derived enzymes. Scandinavian Journal of Immunology, 43, 687-689.
- Svedberg, J., De-Haas, J., Leimenstoll, G., Paul, F. and Teschemacher, H. (1985). Demonstration of a -casomorphin immunoreactive material in vitro digest of bovine milk and in small intestine contents after bovine milk ingestion in adult humans, Peptides, 6, 825-830.
- Takano, T. (2002). Anti-hypertensive activity of fermented dairy products containing biogenic peptides. Antonie van Leeuwenhoek, 82, 333-340.
- Tani, F., Shiota, A., Chiba, H. and Yoshikawa, M. (1994). Serorphin, an opioid peptide derived from bovine serum albumin; in-casomorphins and related peptides recent developments. eds., V Brantl and H Teschemacher, Eds., VCH.VCH-Verlag, 49-53.
- Teschemacher, H., Koch, G. and Brantl, V. (1997). Milk protein-derived opioid receptor ligands. Peptide Science, 43, 99-117.
- Tolstoguzov, V. (2000). Phase behaviour of macromolecular components in biological and food systems. Nahrung, 44, 299-308.
- Tome, D., Dumontier A.M., Hautefeuille M. and Desjeux, J. F. (1987). Opiate activity and transepithelial passage of intact beta-casomorphins in rabbit ileum. American Journal of Physiology, 253, G737-G744.
- Tomita, M., Takase, M., Bellamy, W. and Shimamura, S. (1994). A review: the active peptide of lactoferrin. Acta Paediatrica Japonica, 36(5), 585-591.
- Van Belkum, M. J., Kok, J., Venema, G., Holo, H., Nes, I. F., Konings, W. N. and Abee, T. (1991). The bacteriocin lactococcin A specifically increases permeability of lactococcal cytoplasmic membranes in a voltage-independent, protein-mediated manner. Journal of Bacteriology, 173, 7934-7941.
- Van-Gunsteren, W. F., Billeter, S. R., Eising, A. A., Hünenberger, P. H., Krüger, P., Mark, A. E., Scott, W. R. P. and Tironi, I. G. (1996). Biomolecular simulations: the GROMOS96 manual and user guide. VdF Hochschulverlag ETHZ, Zurich.
- Van’t Hof, R. J. and Ralston, S. H. (2001). Nitric oxide and bone. Immunology, 103, 255-261.
- Vermeirssen, V., Van Camp, J. and Verstraete, W. (2004). Bioavailability of angiotensin-I-converting enzyme inhibitory peptides. British Journal of Nutrition, 92, 357-366.
- Vogel, H. J., Schibli, D. J., Weiguo, J., Lohmeier-Vogel E.M., Epand, R. F. and Epand, R. M. (2002). Towards a structure-function analysis of bovine lactoferricin and related tryptophan and arginine containing peptides. Biochemistry and Cell Biology, 80, 49-63.
- Wright, G. D. (2005). Bacterial resistance to antibiotics enzymatic degradation and modification. Adv. Drug Deliv. Rev., 57, 1451-1470.
- Yamamoto H., Perez-Piteira J., Yoshida T., Terada M., Itoh F., Imai, K. and Perucho, M. (1996). Gastric cancers of the microsatellite mutator phenotype display characteristic genetic and clinical features. Gastroenterology, 116, 1348-1357.
- Yamamoto, N., Akino, A. and Takano T. (1994). Antihypertensive effect of the peptides derived from casein by an extracellular proteinase from Lactobacillus helveticus CP790. Journal of Dairy Science, 77, 917-922.
- Yamamoto, N., Maeno, M. and Takano, T. (1999). Purification and characterization of an antihypertensive peptide from a yogurt-like product fermented by Lactobacillus helveticus CPN4. Journal of Dairy Science, 82, 1388-1393.
- Yamamoto, N., Ejiri, M. and Mizuno, S. (2003). Biogenic peptides and their potential use. Current Pharmaceutical Design, 9, 1345-1355.
- Yamauchi, K. (1992). Biologically functional proteins of milk and peptides derived from milk proteins. Bulletin of the IDF, 272, 51-58.
- Yoshikawa, M., Tani, F., Yoshimura, T. and Chiba, H. (1986). Opioid peptides from milk proteins. Agric. Biol. Chem., 50, 2419-2421.
- Zasloff M. (1987) Magainins, a class of antimicrobial peptides from Xenopus skin: isolation, characterization of two active forms, and partial cDNA sequence of a precursor. Proc Natl Acad Sci USA., 84(15), 5449-5453.
- Zasloff, M. (2002). Antimicrobial peptides of multi cellular organisms. Nature, 415, 389-395.
- Zhao, B., Ye, X., Yu, J., Li, L., Li, W., Li, S., Lin, J. D., Wang, C. Y., Chinnaiyan, A. M. and Lai, Z. C. (2008). TEAD mediates YAP-dependent gene induction and growth control. Genes Development, 22, 1962-1971.
- Zioudrou, C., Streaty, R. A. and Klee, W. A. (1979). Opioid peptides derived from food proteins. Journal of Biology and Chemistry, 254, 2446-2449.