Lo sviluppo della produzione di qualità nutrizionale e funzionale degli alimenti va, oggi, nell’ottica della “One-health” e della corretta informazione del consumatore finale. In particolare, il progresso futuro dell’allevamento in Italia sarà favorito da diversi fattori quali: la sostenibilità ambientale ed economica, il benessere animale, la tracciabilità dei processi produttivi e la qualità delle produzioni, intesa anche come contenuto in molecole con effetto benefico per la salute del consumatore.
Infatti, il futuro delle produzioni animali non dovrà prescindere da un’attenta analisi degli alimenti non solo per i macro-componenti ma anche, e principalmente, per quelle sostanze presenti in minima parte e che rappresentano la base delle difese e della sopravvivenza delle specie animali e vegetali.
La ricerca nel settore degli alimenti, in questi ultimi anni, sta ponendo molta attenzione sia al contenuto di molecole “funzionali”, attive nella modulazione dei processi patofisiologici alla base della prevenzione di diverse patologie, che a quello di molecole “disfunzionali” che, se assunte in grandi quantità e in modo continuativo, possono invece aumentare il rischio di patologie. Il giusto rapporto nel contenuto di queste due classi di molecole può rappresentare un fattore determinate per la qualità degli alimenti.
Il latte di bufala
La produzione di latte è il risultato di un complesso processo endocrino-metabolico utile a favorire il potenziale genetico di un animale. Essa risulta condizionata da fattori ambientali (ad esempio la temperatura, l’umidità, l’escursione termica, la velocità ed esposizione ai venti) e da fattori manageriali (benessere, tecniche di allevamento, alimentazione). Tra questi ultimi, sicuramente il soddisfacimento dei fabbisogni nutrizionali rappresenta il punto focale al fine di ridurre al minimo il ricorso alle riserve endogene e favorire la massima espressione delle potenzialità intrinseche dell’animale stesso. In particolare, uno degli errori che spesso si commette nel razionare la bufala è considerare i gruppi in produzione come entità statiche e non dinamiche. Infatti, il dinamismo del gruppo produttivo è condizionato anche dalla pressione selettiva attuata e di conseguenza dall’età media della mandria che influisce sui fabbisogni nutrizionali di accrescimento a cui vanno aggiunti quelli di produzione. Bisogna inoltre considerare che durante l’anno la disomogenea distribuzione dei parti, particolarmente evidente nella specie bufalina a causa della nota stagionalità riproduttiva, fa sì che l’incidenza dei soggetti ad inizio e a fine lattazione vari notevolmente, rendendo più complesso il razionamento soprattutto negli allevamenti in cui non si effettua la suddivisione in gruppi con diversa lunghezza della lattazione. È noto, infatti, che l’inizio così come la fase finale della lattazione sono caratterizzate da un’elevata lipomobilizzazione di cui si deve tenere conto per ottimizzare la produzione dal punto di vista quanti-qualitativo.
Il latte, oltre ad avere attività nutrizionale, presenta una serie di molecole funzionali bioattive che gli conferiscono un alto potere nutraceutico. Le proteine del latte posseggono un elevato valore biologico, secondo solamente alle proteine contenute nell’uovo. Oltre all’alto contenuto in aminoacidi essenziali, tali proteine sono anche precursori di peptidi biologicamente attivi (in grado cioè di avere un effetto sull’organismo ulteriore rispetto a quello nutrizionale).
Le proteine del latte con attività biologica sono costituite da tre grandi famiglie:
- le caseine (α, β e κ);
- le sieroproteine (immunoglobuline, β-lattoglobuline, α-lattalbumine, lattoferrina e lisozima);
- i fattori di crescita (prolattina, transforming growth factor [TGF], insulin- like growth factor [IGF]).
Inoltre, anche ai peptidi derivanti da tali proteine per digestione enzimatica a livello gastrointestinale o durante le fasi di lavorazione dei prodotti lattiero-caseari sono attribuite molteplici proprietà, tra cui attività agoniste e antagoniste degli oppiacei, antiaggreganti e antipertensive, immunomodulanti, di trasporto di minerali etc.
Infine, altri importanti metaboliti bioattivi, particolarmente abbondanti nel latte di ruminanti, sono la carnitina, alcune acilcarnitine a catena corta (acetil-carnitina, propionil-carnitina, butirril-carnitina,) e le betaine (γ-butirrobetaina, glicinabetaina, δ-valerobetina).
La carnitina
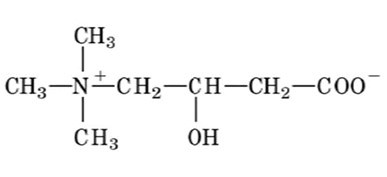
La carnitina è la molecola deputata al trasporto degli acidi grassi a catena lunga dal citoplasma cellulare alla matrice mitocondriale. Questo trasporto è essenziale per il metabolismo energetico della cellula in quanto è nella matrice mitocondriale che gli acidi grassi vengono degradati attraverso la β-ossidazione. Dal punto di vista chimico, la carnitina appartiene alla famiglia dei composti con ammonio quaternario e, pur essendo simile strutturalmente ad un aminoacido, non forma proteine. Nello specifico, la carnitina (3-idrossi-4-trimetilamminobutanoato) è una betaina aminoacidica (Figura 1).
La carnitina è presente in tutte le specie animali e in numerosi organismi e piante, in concentrazioni che variano da un tessuto ad un altro e da una specie ad un’altra. Un uomo in salute di 70 kg ha un contenuto di carnitina all’interno del suo corpo stimato intorno ai 21 grammi (Brass, 1995). La distribuzione della carnitina all’interno del corpo riflette il bisogno di ogni organo nei confronti di questo composto. Il muscolo scheletrico e il cuore, che sono consumatori di carnitina, ne contengono più del 95% all’interno del corpo ed essa raggiunge concentrazioni di tessuto rispettivamente di 1570-3010 nmol/g nel muscolo scheletrico e 420-840 nmol/g nel cuore. Il tessuto epatico rappresenta il sito principale della sintesi della carnitina e presenta livelli compresi tra 570 e 1090 nmol g di tessuto. La carnitina è presente come carnitina libera e come derivati esterificati, o acilcarnitina, che sono prodotti da reazioni catalizzate da enzimi quali le carnitina-aciltransferasi, che utilizzano acil-CoA. Il latte e i prodotti lattiero caseari, benché in misura minore rispetto al pesce e alla carne, sono tra le principali fonti di carnitina. Tale composto è stato identificato per la prima volta nel 1905 nell’estratto di carne bovina, da cui il nome. La sua struttura chimica fu scoperta nel 1927 e fu inizialmente chiamata vitamina T, in quanto essenziale alla crescita del verme della farina Tenebrio molitor.
Gli acidi grassi non possono transitare passivamente attraverso le membrane mitocondriali e, pertanto, vengono legati mediante una reazione ATP-dipendente al Coenzima A (CoA), grazie alla formazione di un legame tioestere tra il gruppo carbossilico dell’acido grasso ed il gruppo tiolico del CoA, formando così acil-CoA secondo la reazione:
Acido grasso + CoA + ATP A ——>Acil-CoA + AMP + Ppi
Metabolismo della carnitina
La principale fonte di carnitina per un organismo è la dieta ma numerosi organismi sono anche in grado di sintetizzarla in maniera endogena. La sintesi di carnitina avviene a partire dagli amminoacidi lisina e metionina. La lisina fornisce lo scheletro di carbonio di questa molecola mentre il gruppo 4-N-metile proviene dalla metionina. In particolare, nei mammiferi le proteine contengono residui di N6 -trimetil-lisina. L’idrolisi lisosomiale di queste proteine porta al rilascio di trimetil-lisina (TML) che è il primo metabolita implicato nella biosintesi della carnitina. Recentemente, è emerso che i vegetali, una componente importante dell’alimentazione per la maggior parte dei mammiferi, rappresentano una delle principali fonti di TML (Servillo et al., 2014). La TML libera, presente a livelli costanti nei foraggi, è particolarmente abbondante nell’erba medica, un importante foraggio per i ruminanti, in cui, a differenza dei non ruminanti, la degradazione e la sintesi della carnitina sono regolati da microrganismi ruminali (Ringseis et al., 2018).
Il trasporto attivo di carnitina dal plasma nei tessuti avviene attraverso una famiglia di trasportatori di cationi carnitina/ organici (OCTN) che mostrano un’ampia specificità anche per altri metaboliti cationici nei tessuti animali, inclusi gli esteri di carnitina e la γ-butirrobetaina (γBB), il precursore della carnitina (Todesco et al.,2008). Oltre a questo metabolita, anche la δ-valerobetaina (δVB), un metabolita costitutivo recentemente identificato nel latte e nella carne dei ruminanti (Servillo et al., 2018), viene biosintetizzata a livello del rumine a partire dalla TML. La δVB infatti è diversamente distribuita nel latte dei ruminanti e non ruminanti, con livelli più elevati in bovini, caprini e pecore (Figura 2).

Figura 2 – Distribuzione del contenuto di δ-valerobetaina nel latte di ruminanti e non ruminanti. Il livello dei composti (moli/kg) è espresso come media ± SD (Servillo et al., 2018).
Tra i ruminanti, il latte di bufala, il secondo latte più consumato al mondo, è uno dei più ricchi da un punto di vista qualitativo, con contenuto in grassi, minerali e proteine superiore a quello del latte vaccino (Warriach et al., 2015). Queste peculiari caratteristiche lo rendono particolarmente adatto alla produzione di prodotti caseari, tra cui yogurt, panna di qualità superiore, burro e formaggi a pasta tenera e dura, ma, in particolare per le mozzarelle, prodotte in Italia nell’ambito del regime di denominazione di origine protetta dell’Unione Europea. A questo proposito, la bufala mediterranea italiana ha raggiunto alti livelli di produttività e di riproduttività grazie ai notevoli progressi genetici (Pasquini et al., 2018). Data la ricchezza della composizione, il latte di bufala mostra proprietà salutistiche diverse da quelle del latte vaccino, poiché possiede un potenziale a basso allergene e ha un effetto benefico per l’obesità, l’ipertensione e l’osteoporosi (Ahmad, 2013). Un aumento delle conoscenze riguardanti il contenuto dei peptidi bioattivi, potrebbe essere utile per guidare l’industria lattiero-casearia verso la produzione di latte di bufala e prodotti a base di latte di bufala con migliori proprietà nutrizionali. La presenza di δVB, recentemente descritta nel latte, ha aperto un nuovo scenario sul metabolismo dei ruminanti con conseguenze importanti nella salute dei consumatori (Servillo et al, 2018).
Il potenziale salutistico
La δVB ha importanti attività biologiche. Essa protegge le cellule endoteliali dai danni ossidativi e infiammatori indotti dal diabete di tipo 2 (D’Onofrio et al, 2019). Il potenziale salutistico del latte di bufala contente alti livelli di δVB si espleta attraverso proteine della longevità, la sirtuina 1 e 6. Tale proprietà conferisce alla δVB un ruolo potenziale quale componente alimentare bioattivo (D’Onofrio et al, 2019). Le sirtuine (SIRT=silent regulator information transcript) sono proteine coinvolte nella regolazione dell’espressione genica (Singh et al., 2018). Esse rivestono un ruolo importante nella regolazione delle principali vie metaboliche e dei meccanismi molecolari alla base di patologie cronico degenerative legate all’invecchiamento (diabete di tipo 2, osteoporosi, ipertensione, cancro, patologie cardiovascolari) (Sergi et al., 2019, D’Onofrio et al., 2018, Khan et al., 2018).
E’ importante notare che alti livelli di carnitina e di acil-carnitine a catena corta nel latte, oltre al loro ruolo fisiologico nella crescita e nello sviluppo del vitello, hanno notevoli implicazioni legate alle loro note proprietà salutistiche. Studi recenti (Salzano et al., 2019), inoltre, riportano che nella specie bufalina la quantità dei suddetti metaboliti funzionali è condizionata dalle tecniche di allevamento e, in particolare, dallo stato di benessere che condiziona lo stress ossidativo degli animali.
L’industria bufalina rappresenta una realtà economica rilevante per il settore agro-alimentare italiano e per le regioni meridionali in particolare. L’interesse nei confronti della specie e delle potenzialità in termini di produzione di molecole funzionali è aumentato sensibilmente nel corso degli ultimi anni, in quanto è ormai stato dimostrato il ruolo insostituibile del bufalo come produttore di proteine animali e di prodotti salutistici. Parallelamente, è cresciuto l’interesse nei confronti delle derrate alimentari derivanti dalla lavorazione del latte ma anche per quanto riguarda i prodotti carnei, il tutto attestato dalla sempre crescente domanda e dal posizionamento dei suddetti prodotti in nuovi mercati nazionali ed esteri. E’ pertanto di fondamentale importanza che vengano rafforzate le strutture operative impegnate nei percorsi di valorizzazione delle produzioni, di miglioramento qualitativo e di miglioramento delle condizioni di benessere degli allevamenti bufalini.
Autori: Angela Salzano, Maria Luisa Balestrieri e Giuseppe Campanile
Riferimenti
Ahmad S, Park Y.W., Haenlein G.F.W. Buffalo milk. Milk and Dairy Products in Human Nutrition: Production, Composition and Health 2013, 519−553.
Brass E.P. Pharmacokinetic considerations for the therapeutic use of carnitine in hemodialysis patients. Clin Ther. 1995;17(2):176-85.
D’Onofrio N, Balestrieri A, Neglia G, Monaco A, Tatullo M, Casale R, Limone A, Balestrieri M.L., Campanile G. Antioxidant and anti-inflammatory activities of buffalo milk δ-valerobetaine. J. Agric. Food Chem. 67, 1702-1710 (2019).
D’Onofrio N, Servillo L, Balestrieri ML*. SIRT1 and SIRT6 signalings in cardiovascular disease protection. Antioxidant Redox Signaling 28:711-732, 2018
Engel A.G., Rebouche C.J. Carnitine metabolism and inborn errors. J Inherit Metab Dis. 1984;7(1):38-43.
Khan RI, Nirzhor SSR, Akter R. A Review of the Recent Advances Made with SIRT6 and its Implications on Aging Related Processes, Major Human Diseases, and Possible Therapeutic Targets. Biomolecules. 2018;8(3):44.
Pasquini M, Osimani A, Tavoletti S, Moreno I, Clementi F, Trombetta M.F. Trends in the quality and hygiene parameters of bulk Italian Mediterranean buffalo (Bubalus bubalis) milk: a three year study. Anim. Sci. J. 2018, 89, 176−185.
Ringseis, R.; Keller, J., Eder, K. Regulation of carnitine status in ruminants and efficacy of carnitine supplementation on performance and health aspects of ruminant livestock: a review. Arch. Anim. Nutr. 2018, 72, 1-30.
Salzano A, Licitra F, D’Onofrio N, Balestrieri M.L., Limone A, Campanile G, D’Occhio M.J., Neglia G. Short communication: Space allocation in intensive Mediterranean buffalo production influences the profile of functional biomolecules in milk and dairy products. J. Dairy Sci. 102, 7717-7722 (2019).
Sergi C, Shen F, Liu SM. Insulin/IGF-1R, SIRT1, and FOXOs Pathways-An Intriguing Interaction Platform for Bone and Osteosarcoma. Front Endocrinol (Lausanne). 2019;10:93.
Servillo L, D’Onofrio N, Giovane A, Casale R, Cautela D, Castaldo D, Iannaccone F, Neglia G, Campanile G, Balestrieri M.L. Ruminant meat and milk contain δ-valerobetaine, another precursor of trimethylamine N-oxide (TMAO) like γ-butyrobetaine. Food Chem. 2018, 260, 193−199.
Servillo L, Giovane A, Cautela D, Castaldo D, Balestrieri M.L. Where does N(ε)-trimethyllysine for the carnitine biosynthesis in mammals come from? PLoS One 2014, 9, No. e84589.
Singh CK, Chhabra G, Ndiaye MA, Garcia-Peterson LM, Mack NJ, Ahmad N. The Role of Sirtuins in Antioxidant and Redox Signaling. Antioxid Redox Signal. 2018;28(8):643‐661.
Subramaniam S, Fletcher, C. Trimethylamine N-oxide (TMAO): breathe new life. British Journal of Pharmacology (2018), 175(8), 1344–1353.
Todesco L, Bur D, Brooks H, Török M, Landmann L, Stieger B, Krähenbühl S. Pharmacological manipulation of Lcarnitine transport into L6 cells with stable overexpression of human OCTN2. Cell. Mol. Life Sci. 2008, 65, 1596−1608.
Warriach H.M., McGill D.M., Bush R.D., Wynn P.C., Chohan K.R. A review of recent developments in buffalo reproduction – a review. Asian-Australas J Anim Sci. 2015;28(3):451‐455.