Con questo articolo proseguiamo nella presentazione del Programma Stress da Caldo, approfondendo per mezzo di alcuni studi scientifici, tra cui quello della Texas Tech University, il concetto chiave, qui già più volte discusso, su cui si articolano i Programmi Phileo: ottimizzare la sinergia, e gli effetti benefici che ne derivano, tra i vari “interpreti”.
I meccanismi che alterano la ripartizione dei nutrienti durante lo stress da caldo non sono del tutto chiari, ma sono certamente influenzati dagli effetti che questo produce sulla salute e sulla funzione intestinale (Stoakes et al., 2014).
Durante lo stress da caldo, il flusso sanguigno viene deviato verso le zone periferiche per dissipare il calore attraverso la pelle (Lambert et al., 2002). L’intestino tenue è il primo a soffrire di un ridotto flusso di sangue ai visceri e gli enterociti sono particolarmente sensibili all’ipossia e alla carenza di nutrienti. Ciò pregiudica le giunzioni strette riducendone la funzione di barriera intestinale (Lambert et al., 2002; Pearce et al., 2013b), che causa la mobilitazione dei lipopolisaccaridi (LPS) dall’intestino alla circolazione sistemica (Hall et al., 2001; Pearce et al.,2013b). Gli LPS sono endotossine che si trovano nei batteri Gram-negativi e, se traslocate nel sistema circolatorio, inducono una reazione immunitaria sistemica (Andersen et al., 1994). Questa traslocazione stimola il rilascio di citochine proinfiammatorie, come l’interleuchina-1 (IL-1), IL-6 e il fattore di necrosi tumorale-α (TNF-α) (Gabay C. et al., 1999). La traslocazione di endotossine nel flusso sanguigno provoca cambiamenti metabolici e induce una risposta infiammatoria sistemica (Ametaj et al., 2009).
Figura 1: Effetto dello stress da calore su giunzioni strette, citochine proinfiammatorie e permeabilità intestinale.
Durante lo stress da caldo, i livelli di LPS nel sangue aumentano e i livelli di LBP diminuiscono (Pearce at al., 2014).
Figura 2: LPS-binding protein (LBP) e livelli di endotossina durante lo stress da calore.
L’infiammazione sistemica causata dalla traslocazione di LPS durante lo stress termico provoca l’innalzamento della temperatura corporea e aumenta i livelli di citochine proinfiammatorie.
I cambiamenti dei livelli di insulina, glucosio e cortisolo nei ruminanti durante lo stress da calore sono simili ai cambiamenti osservati nell’infiammazione sistemica. Questo suggerisce che alcuni degli effetti negativi dello stress termico siano legati alle reazioni infiammatorie causate come risposta immunitaria alla mobilitazione delle endotossine. L’infiammazione riduce le prestazioni e aumenta la domanda di energia, che viene fornita al sistema immunitario sotto forma di glucosio, lasciando meno energia disponibile per la sintesi del lattosio e, quindi, per la produzione di latte. L’adozione di strumenti per ridurre l’infiammazione sistemica dovrebbero essere combinata ed integrata con la gestione e le strategie nutrizionali, per ridurre al minimo le perdite di performance durante lo stress da calore.
È stato dimostrato che il lievito probiotico e i derivati del lievito prebiotici migliorano l’integrità intestinale rafforzando le giunzioni strette, riducendo la traslocazione di LPS e modulando il sistema immunitario per una reazione più efficace all’impatto delle endotossine. E’ stata anche dimostrata la riduzione di batteri patogeni, come E. coli, in vitro e in vivo.
Figura 3: Effetti di Actisaf® e Safmannan® sulla crescita di Escherichia coli O157: H7, Salmonella Typhimurium e Listeria monocytogenes (Carroll, 2015. Studio in vitro, USDA).
Figura 4: Batteri presenti nel retto in bovini da carne al macello che hanno ricevuto Actisaf® e Safmannan® (Morgante, 2016. Dipartimento di Medicina, Produzione e Salute degli Animali, Università di Padova, Italia).
I probiotici e i prebiotici del lievito possono ridurre l’infiammazione sistemica a fronte di un “attacco” di LPS. Determinati ceppi di lievito possono modulare il sistema immunitario e hanno dimostrato un effetto anti-infiammatorio durante un challenge intravenoso con E. coli e LPS in un test su 24 bovini da carne. A tal proposito è stato svolto uno studio presso la Texas Tech University (Finck et al., 2014), dove gli animali sono stati divisi in 4 gruppi: Controllo, Actisaf®, Safmannan®, Actisaf®+Safmannan® e alimentati con la stessa dieta di base, più i relativi trattamenti (se presenti). I bovini sono stati dotati di cateteri venosi giugulari e di dispositivi di registrazione per la temperatura rettale individuale (RT) (Reuter et al., 2010) e collocati in box singoli (2,13 × 0,76 m), con accesso ad libitum di acqua. È stato somministrato un LPS (0,25 μg/kg di LPS BW, Escherichia coli O111: B4; Sigma-Aldrich, St. Louis, MO) come inizio dello studio al tempo 0 h. Sono stati quindi analizzati campioni di sangue per il monitoraggio di citochine proinfiammatorie.
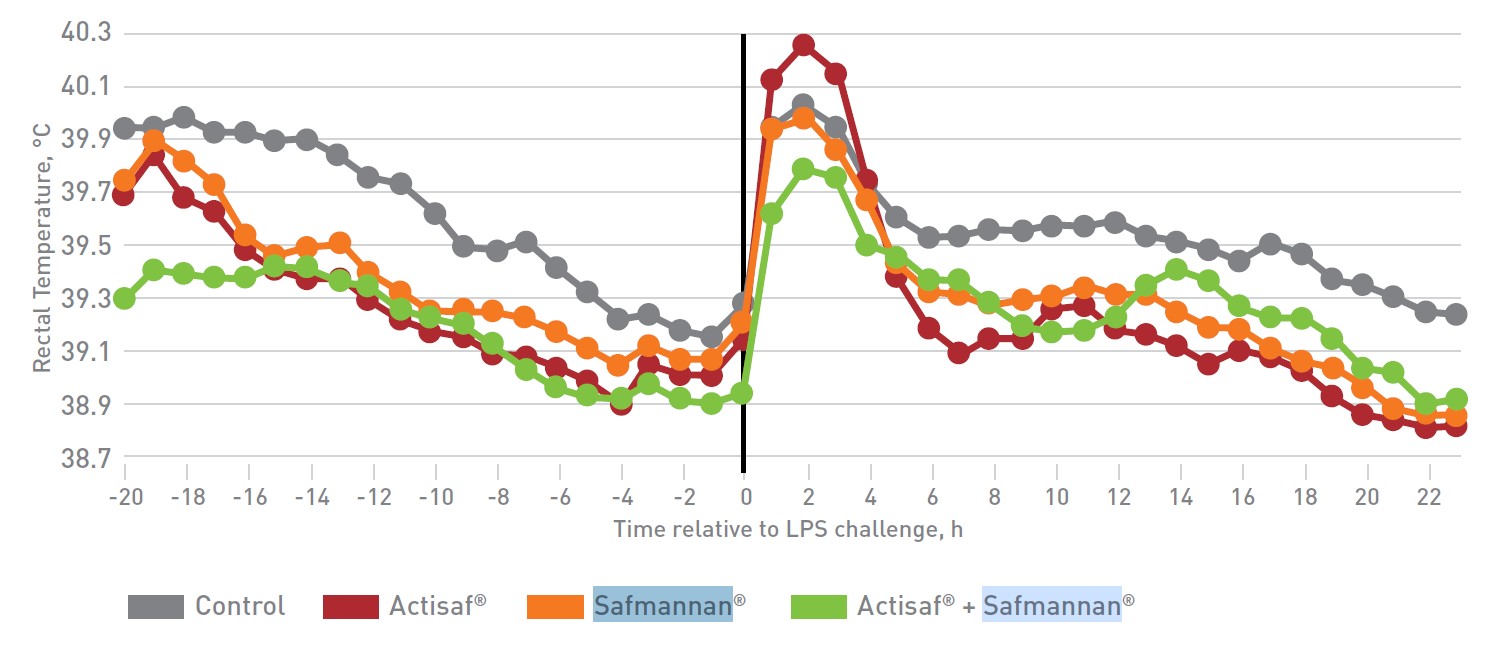
Figura 5: Effetti sulla temperatura rettale.
Prima della somministrazione dell’LPS, la RT basale tendeva (p = 0,06) a differenziarsi tra i gruppi. Gli animali del gruppo controllo hanno poi registrato una RT superiore rispetto ai gruppi Actisaf®+Safmannan® (p ≤ 0,01) e Actisaf® (p ≤ 0,04). La RT è aumentata (p <0,01) in tutti gli animali entro 1 ora dopo la somministrazione di LPS, con un picco che si è verificato a circa 2 ore. La RT è rimasta più alta negli animali controllo (p ≤ 0,05) rispetto a tutti gli altri animali trattati per l’intero periodo post-LPS. Gli animali che hanno ricevuto Actisaf® e Safmannan® (da soli o in combinazione) erano più sani prima del challenge e hanno recuperato la temperatura corporea normale molto più rapidamente.
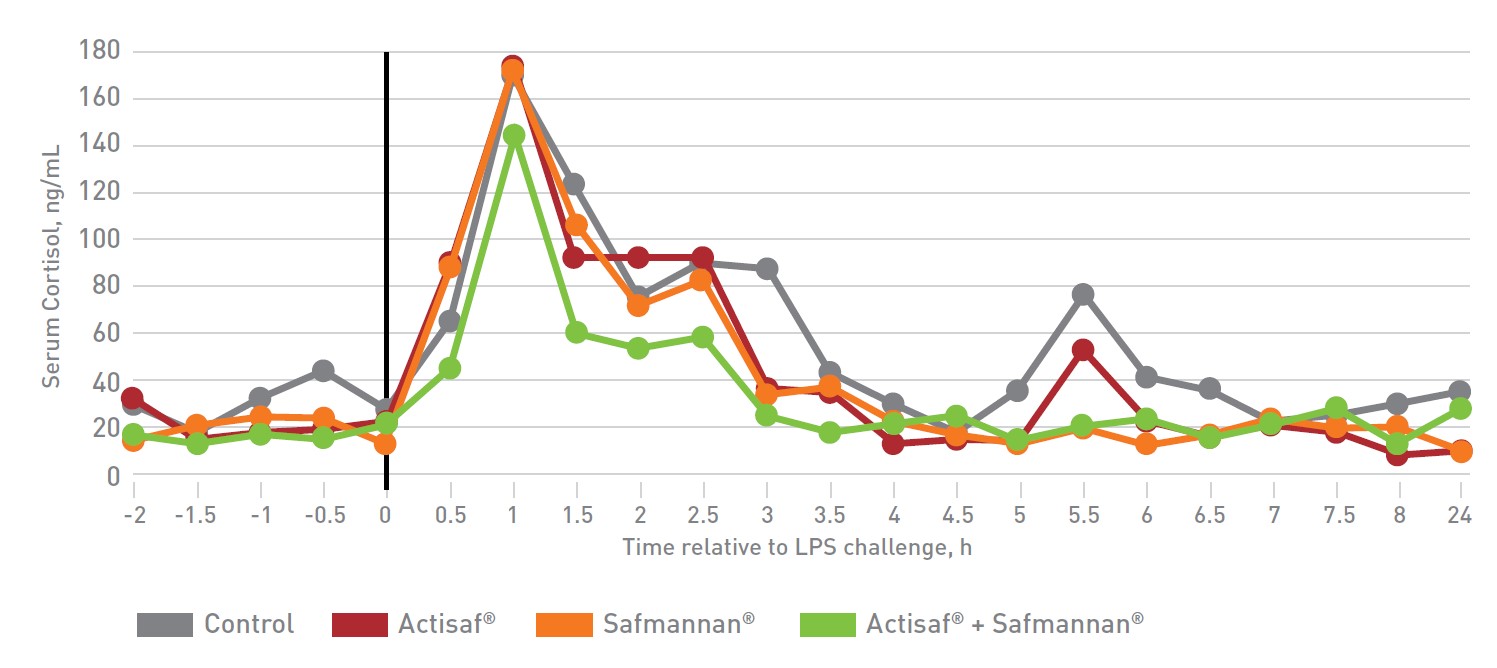
Figura 6: Effetto sul cortisolo sierico (Finck et al., 2014).
Le concentrazioni sieriche di cortisolo erano uguali in tutti i gruppi di trattamento prima della somministrazione di LPS (p> 0,05).
I livelli di cortisolo sono aumentati in risposta a LPS e hanno raggiunto il picco ad 1 h post-LPS in tutti i gruppi di trattamento, con picchi più alti di concentrazione di cortisolo osservati negli animali del gruppo controllo (p <0,04) rispetto agli animali trattati con Actisaf®+ Safmannan®.
Il cortisolo è un indicatore di stress nei ruminanti. Livelli elevati sono correlati a un’aumentata richiesta di glucosio. Il cortisolo regola la gluconeogenesi e aumenta la produzione di glucosio da amminoacidi in risposta ad una maggiore richiesta di questo zucchero durante l’infiammazione e lo stress.
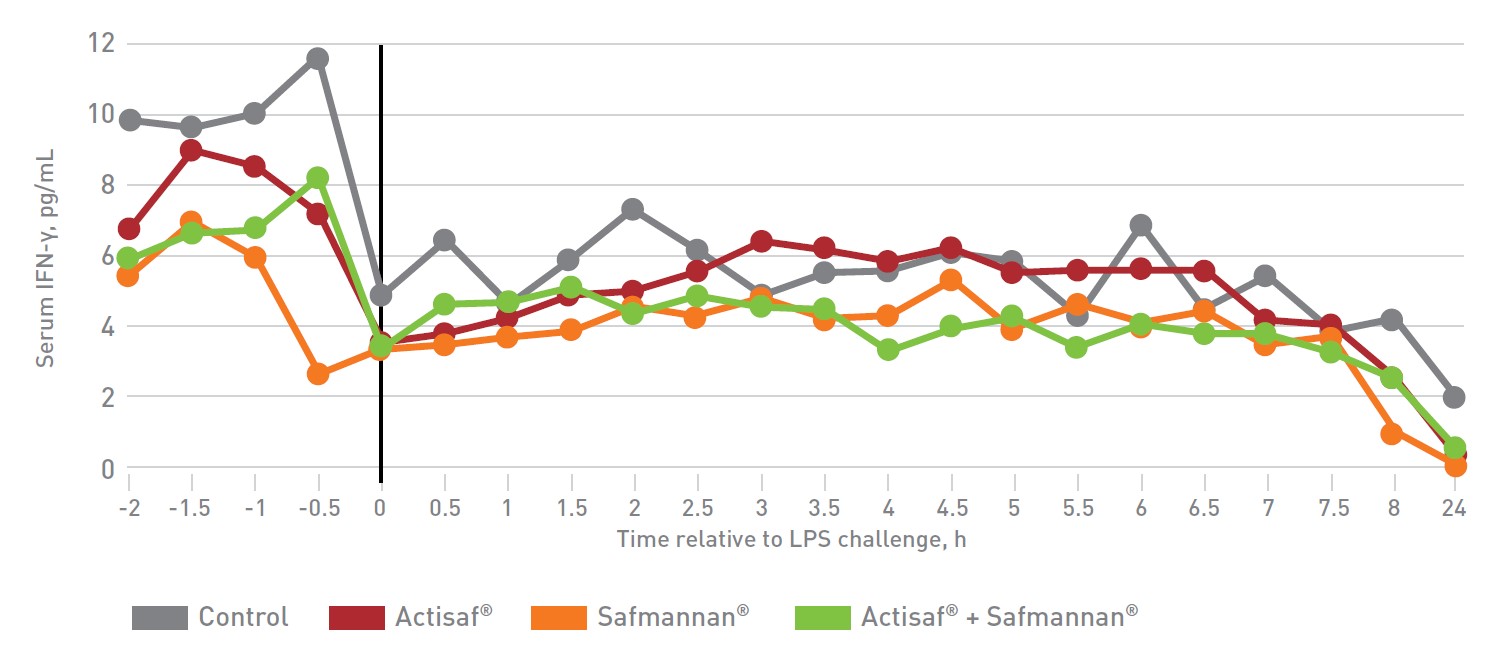
Figura 7: Effetto sulla IFN-γ sierica (Finck et al., 2014)
IFN-γ è una citochina proinfiammatoria che aumenta durante l’infiammazione. Prima della applicazione di LPS, i livelli sierici basali di IFN-γ erano uguali (p> 0,10) tanto nel gruppo controllo quanto nei gruppi di trattamento. Per l’intero periodo post-LPS i livelli di IFN-γ (p ≤ 0,06) sono stati tendenzialmente più elevati nel gruppo controllo rispetto agli animali trattati con Safmannan® e Actisaf®+Safmannan®. Questo è indice di minori livelli di infiammazione dovuti all’effetto immunomodulatore del lievito probiotico e del prebiotico.
Conclusione
L’integrazione con lievito probiotico (Actisaf®) e prebiotico (Safmannan®) durante i periodi di stress da calore può aiutare a ridurre la permeabilità dell’intestino e controllare le infiammazioni correlate alla traslocazione dell’endotossina batterica (LPS). Le soluzioni studiate sono ingredienti multifunzionali la cui sinergia può manifestare diverse proprietà benefiche in tutti i tratti dell’apparato digerente dei ruminanti. Gli studi della cinetica di Actisaf® e Safmannan® nella vacca da latte hanno dimostrato che i due supplementi sono prontamente disponibili e metabolicamente attivi per tutto il tratto gastrointestinale, dal rumine alle feci. Questa multifunzionalità di Actisaf® e Safmannan® rende di rilevante importanza la loro inclusione in un programma di gestione dello stress da caldo, unitamente ad altre strategie, per ridurre il sovraccarico di calore e aumentare l’efficienza alimentare.