Il periparto per la vacca da latte, così come il periodo neonatale per il vitello, sono caratterizzati da una combinazione di stress multipli che aumentano la suscettibilità alle malattie e impattano negativamente la capacità degli animali di superare malattie e di ristabilire l’omeostasi (Aleri et al., 2016). Infatti, l’abilità dell’animale di produrre una risposta appropriata nei confronti di stimoli che possano costituire una minaccia per l’omeostasi è essenziale per la sua sopravvivenza.
L’omeostasi è coordinata da fattori metabolici tra cui l’asse ipotalamo-ipofisi-surrene (HPA), una delle più importanti risposte neuroendocrine che avvengono a seguito di condizioni stressanti e che regola anche la produzione di cortisolo (Arfuso et al., 2021; Diez‐Fraile et al., 2003). Il cortisolo, conosciuto come l’ormone dello stress, guida il metabolismo che agisce su lipolisi, gluconeogenesi e glicogenosintesi. Inoltre, a causa dei suoi effetti antinfiammatori, è noto anche come ormone immunosoppressivo (Elenkov and Chrousos, 2002). L’asse HPA ed il sistema immunitario comunicano tra di loro e lavorano in sinergia per mantenere l’omeostasi dell’animale (Arfuso et al., 2021, 2022) ma questa relazione cambia in funzione delle condizioni fisiologiche dello stesso. Durante il periodo del periparto, le vacche da latte affrontano una disregolazione del sistema immunitario e un aumento dello stato infiammatorio (Fiore et al., 2017; Lopreiato et al., 2020). Ciò può avere ripercussioni negative anche sul vitello, compromettendo una transizione di successo dalla vita intra-uterina alla vita extra-uterina; infatti il vitello appena nato deve affrontare processi cruciali al fine di adattarsi all’ambiente extrauterino, tra cui la transizione dalla circolazione fetale a quella adulta, l’inizio della respirazione polmonare, il cambiamento del sistema digestivo, per il passaggio dal sostentamento con nutrienti ombelicali, alla digestione del latte attraverso l’alimentazione con bottiglia o secchio.
In questo articolo sono riassunti i risultati dello studio condotto da Francesca Arfuso et al, il cui obiettivo è stato quello di evidenziare i cambiamenti dinamici nella concentrazione di cortisolo come marcatore di stress, l’Interleuchina 6 (IL6) e l’aptoglobina come marcatori di risposta infiammatoria, e le popolazioni di leucociti come indici immunitari sia nelle vacche periparturienti che nei loro vitelli appena nati. Inoltre, lo studio ha valutato la potenziale relazione tra asse HPA, stato immunitario e infiammatorio sia nelle vacche che nei vitelli in risposta ai processi dinamici di adattamento fisiologico che caratterizzano il passaggio dal periodo del preparto al periodo postpartum della vacca e neonatale del vitello.
Nello studio sono state considerate 8 vacche Simmental (5 pluripare e 3 primipare), durante il periodo di transizione, e i loro vitelli, 5 femmine e 3 maschi. Nelle vacche sono stati eseguiti campionamenti di sangue a -21, 0, +1, + 7 e +21 giorni dal parto. Il sangue nei vitelli è stato prelevato dopo il parto prima dell’assunzione di colostro (0), a 1,7 e 15 giorni di età. La concentrazione di cortisolo, IL-6 e aptoglobina è stata rilevata tramite tecnica ELISA; i globuli bianchi (WBC) sono stati rilevati tramite ADVIA 2120 Hematology System.
I risultati raccolti nel presente studio confermano che il parto rappresenta l’evento più stressante per le vacche, come evidenziato dalla maggiore concentrazione di cortisolo riscontrata durante questa fase piuttosto che durante il pre e il postpartum. Inoltre, è emersa una elevata correlazione positiva (Fig.1) tra i valori di cortisolo misurati nelle vacche il giorno del parto e quelli rilevati nei vitelli dopo il parto, ma prima dell’assunzione di colostro (Fig. 2) suggerendo che il cortisolo viene trasferito dalla vacca al vitello neonato solamente attraverso la placenta e non attraverso il colostro.
Figura 1.
A) Relazione tra la concentrazione ematica di cortisolo delle vacche al parto (giorno del parto) e la concentrazione ematica di cortisolo dei relativi vitelli dopo la nascita e prima dell’ingestione di colostro
B) Relazione tra la concentrazione ematica di IL-6 delle vacche al parto (giorno del parto) e la concentrazione ematica di IL-6 dei relativi vitelli dopo la nascita e prima dell’ingestione di colostro
C) Relazione tra la concentrazione ematica di IL-6 delle vacche 1 giorno dopo il parto e la concentrazione ematica di IL-6 dei relativi vitelli dopo la nascita e prima dell’ingestione di colostro.
In effetti, il segnale del parto, così come lo stress fetale, per stimolare i meccanismi del parto, attiva l’asse HPA e il sistema nervoso simpatico, che a loro volta stimolano il rilascio di ormoni dello stress, tra cui glucocorticoidi e catecolamine. Pertanto, l’alta concentrazione di cortisolo nella bovina al parto è prevedibile, e può essere attribuita alla secrezione di cortisolo fetale, ad uno stato di stress dell’animale stesso dovuto alla condizione del parto a partire dall’asse HPA, così come lo stress associato con l’inizio della lattazione (Alhussien et al., 2021).
La risposta allo stress acuto attraverso il rilascio di cortisolo altera la funzionalità immunitaria cellulare, inibendo l’espressione dei geni coinvolta nell’attivazione delle cellule T e nella produzione di citochine. La risposta infiammatoria, che porta al rilascio di un gran numero di citochine pro-infiammatorie come IL-6, è benefica in quanto attrae le cellule immunitarie circolanti per affrontare l’infezione; tuttavia, le risposte infiammatorie eccessive possono creare danni a tessuti e organi. Pertanto, l’espressione di mediatori infiammatori e citochine pro-infiammatorie deve essere strettamente regolata durante una risposta infiammatoria. A questo proposito, si può ipotizzare che il cortisolo potrebbe svolgere un effetto protettivo, modulando la risposta infiammatoria durante il periparto nelle vacche e, più specificamente, intorno al parto.
Per quanto riguarda le citochine infiammatorie, esse svolgono un ruolo cruciale nella risposta metabolica, immunitaria e infiammatoria nelle vacche in transizione (Yoshioka et al., 2002).
Secondo i risultati qui riportati, alti valori di IL-6 sono stati osservati prima del parto con un drastico calo al momento del parto e rimanendo inferiore fino a 21 giorni dopo il parto. Ciò potrebbe essere dovuto al fatto che placenta, amnion e miometrio rappresentano fonti di IL-6 (Rice, 2001), giustificando dunque i valori più elevati di IL-6 riscontrati prima del parto rispetto al post-parto. La concentrazione di IL-6 è stata notevolmente ridotta al parto e, sebbene non sia ancora ben comprensibile il motivo, molti ricercatori hanno attribuito la sua diminuzione al forte aumento di 17 b-estradiolo e cortisolo che si verificano nel periparto (Goff & Horst, 1997; Rogers & Eastell, 2001).
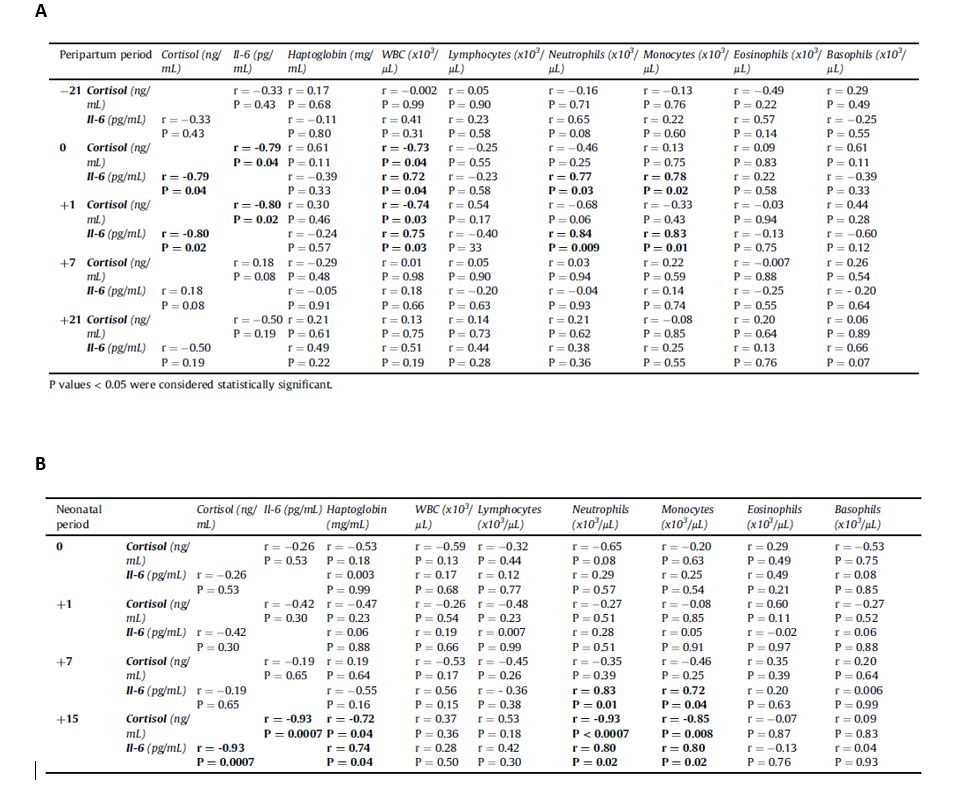
Tre settimane prima del parto, quando i valori di IL-6 erano alti, la concentrazione di aptoglobina era bassa. Notevole, anche se non significativa, la relazione negativa tra IL-6 e aptoglobina riscontrata nelle vacche durante il periparto, come suggerito dal valore negativo del coefficiente di correlazione (Figura 2). Pertanto, gli elevati valori di IL-6 rilevati durante il preparto non suggerirebbero uno stato infiammatorio migliorato, contrariamente a quanto precedentemente ipotizzato (Lopreiato et al., 2019), ma la maggiore concentrazioni di questa citochina potrebbe riflettere una grande funzionalità delle cellule immunitarie. Si potrebbe dunque ipotizzare che l’elevato valore di IL-6 durante il periparto, potrebbe rientrare nell’andamento fisiologico di questo particolare periodo, e che potrebbe preparare ad una risposta immunitaria adeguata ad affrontare momenti critici come il parto. Questa ipotesi sembra essere rafforzata dalla correlazione positiva tra la concentrazione di IL-6 e i valori del numero totale di leucociti, neutrofili e monociti durante il periparto, quando le vacche hanno mostrato i valori più alti.
Figura 2.
A) Correlazione di Pearson tra la concentrazione di cortisolo e/o IL-6 e i livelli di aptoglobina, leucociti totali circolanti, linfociti, neutrofili, monociti, eosinofili e basofili di vacche pezzate rosse durante il periodo di transizione (da -21 a +21 giorni relativi al parto). Un valore di P < 0.05 indica una correlazione statisticamente significativa.
B) Correlazione di Pearson tra la concentrazione di cortisolo e/o IL-6 e i livelli di aptoglobina, leucociti totali circolanti, linfociti, neutrofili, monociti, eosinofili e basofili di vitelli di razza pezzata rossa durante il periodo neonatale (dalla nascita a 15 giorni di vita). Un valore di P < 0.05 indica una correlazione statisticamente significativa.
La concentrazione di IL-6 era più bassa è stata osservata al momento del parto e il giorno dopo, mentre i valori di aptoglobina sono aumentati, suggerendo una risposta in fase acuta. L’aumento della concentrazione di questa proteina di fase acuta positiva intorno al periodo del parto potrebbe essere influenzata da una diversa suscettibilità delle vacche all’infiammazione dovuta allo stress durante l’evento del parto (Regassa & Noakes, 1999). Oltretutto, i processi fisiologici che avvengono intorno al momento del parto, tra cui l’aumento dell’attività miometriale, l’involuzione dell’utero, la degenerazione e la rigenerazione dell’endometrio, sono noti per essere potenti induttori di proteine in fase acuta (Fleck, & Myers, 1985) e possono essere responsabili dei maggiori valori di aptoglobina riscontrati nelle vacche al parto e il giorno dopo.
Il periodo neonatale rappresenta sicuramente anche per la prole una fase cruciale; secondo i nostri risultati, è stato riscontrato un effetto temporale su cortisolo, IL-6, aptoglobina, WBC, linfociti, monociti, eosinofili e basofili nei vitelli dalla nascita fino a 15 giorni di età. Come previsto, è stata osservata una maggiore concentrazione di cortisolo alla nascita confermando che la transizione dalla vita intra-extrauterina rappresenta un evento stressante per i vitelli appena nati a causa dei drastici cambiamenti delle condizioni ambientali. La concentrazione di cortisolo ha mostrato una correlazione negativa con i valori di IL-6, aptoglobina, neutrofili e monociti che sono diventati significativi ai 15 giorni di età. Questi risultati sono dati dal ruolo immunosoppressivo del cortisolo con effetti antinfiammatori (Aleri et al., 2016; Elenkov and Chrousos, 2002). La mancanza di correlazione significativa tra cortisolo, indici di immunità e infiammazione durante la prima settimana di vita dei vitelli potrebbe suggerire che la relazione tra asse HPA, immunità e stato infiammatorio non è completamente matura nel vitello appena nato. I valori di IL-6, leucociti totali, linfociti, monociti e basofili hanno mostrato un trend crescente a partire dall’assunzione di colostro, mentre l’aptoglobina ha seguito una tendenza opposta.
Il colostro, grazie al suo contenuto in anticorpi e cellule immunitarie, contribuisce al trasferimento dell’immunità locale e sistemica al vitello appena nato (Chase, 2018). Anche se la funzione più importante del colostro è quella di fornire anticorpi al neonato con almeno 50 mg/ ml di IgG totale, contiene anche sostanze nutritive e composti bioattivi come fattori di crescita, ormoni, citochine e colesterolo che interagiscono o stimolano programmi biologici nel rivestimento degli enterociti nativi o immaturi dei neonati causando maturazione intestinale (Osorio, 2020). Così come hanno riportato Osorio (2020) e Menge et al (1998), i risultati del nostro studio suggeriscono che l’IL-6 è stata trasferita attraverso il colostro, come evidenziato dalla forte correlazione positiva tra i valori IL-6 ottenuti dalle vacche durante il periparto e quelli ottenuti nei vitelli al primo giorno di età, dopo l’assunzione di colostro. Tra le citochine fornite attraverso il colostro, l’IL-6 è associata ad una risposta pro-infiammatoria e consente il reclutamento e lo sviluppo dei linfociti neonatali nell’intestino migliorando la fagocitosi e l’esplosione ossidativa nei neutrofili (Menge et al., 1998). In accordo con questa evidenza, i risultati qui riportati hanno mostrato che nei vitelli appena nati l’IL-6 è correlata positivamente con i neutrofili e con i monociti a 7 e 15 giorni di vita, e con l’aptoglobina a 15 giorni. Questo poiché l’IL-6 è coinvolta nella risposta immunitaria innata (un forte precursore della risposta delle proteine di fase acuta), suggerendo che stimoli l’inizio di infiammazione in vitelli neonati. Tuttavia, allo stesso tempo, le citochine antinfiammatorie sono presenti anche nel colostro, ed aiutano a ridurre le condizioni infiammatorie locali (den Hartog et al., 2011). Quanto detto è evidente nei nostri risultati, mostrando una tendenza decrescente della concentrazione di aptoglobina nei vitelli dopo l’assunzione di colostro (Figura 2). Questa tendenza sembra indicare che, al contrario di altre proteine che sono abbondanti nel colostro, l’aptoglobina non pare essere trasferita nella circolazione ematica del vitello, come riportato da Gruse et al (2016) e da Sadri et al (2020).
In realtà, mentre tutti i principali componenti del sistema immunitario adattativo sono completamente sviluppati da 1 mese prima della nascita nel vitello (Chase, 2018), il sistema immunitario innato nel neonato è immaturo e si presume che la produzione endogena di aptoglobina sia bassa poiché la sintesi epatica dell’aptoglobina non è ancora completamente sviluppata nei vitelli neonati (Sadri et al., 2020).
I risultati raccolti nel presente studio portano nuove ipotesi sulle conoscenze attualmente disponibili sull’adattamento fisiologico delle vacche durante il periparto e dei vitelli durante l’avvio del periodo neonatale. In particolare, questo studio suggerisce che la funzione immunitaria durante la gravidanza nelle vacche è in uno stato attivo piuttosto che in uno stato debilitato, e che l’asse HPA potrebbe svolgere un ruolo importante negli aggiustamenti immunomodulatori che si verificano durante il periodo di transizione nelle vacche.
I risultati confermano inoltre che il periodo neonatale impone una risposta adattiva immediata della prole alla vita extrauterina, caratterizzata da diversi cambiamenti fisiologici. Sebbene i vitelli siano nati con cellule complete e altri componenti che costituiscono le basi dell’immunità innata e adattativa, il metabolismo epatico così come il cross-talking tra l’asse HPA, risposta immunitaria e risposta infiammatoria non è completamente sviluppato alla nascita.
Inoltre, secondo il presente studio, si può affermare che l’IL-6 misurata in vacche durante il periparto può influenzare notevolmente anche i vitelli nelle prime 24 ore dopo il parto, a causa del trasferimento di questa citochina attraverso il colostro. Al contrario, anche se i livelli di cortisolo ematici misurati nelle vacche al momento del parto influenzano quelli dei vitelli alla nascita, possiamo ritenere che il cortisolo venga trasferito dalla vacca al vitello solo attraverso la placenta, e non con il colostro.
Sinossi curata dalla Dott.ssa Francesca Arfuso.
Articolo: Arfuso F.; Minuti A.; Liotta L.; Giannetto C., Trevisi E.; Piccione G.; Lopreiato V. 2022. Stress and inflammatory response of cows and their calves during peripartum and early neonatal period. Theriogenology 196:157-166. doi.org/10.1016/j.theriogenology.2022.11.019.
BIBLIOGRAFIA
Aleri, J. W., Hine, B. C., Pyman, M. F., Mansell, P. D., Wales, W. J., Mallard, B., & Fisher, A. D. (2016). Periparturient immunosuppression and strategies to improve dairy cow health during the periparturient period. Research in Veterinary Science, 108, 8–17. https://doi.org/10.1016/j.rvsc.2016.07.007
Alhussien, M. N., Tiwari, S., Panda, B. S. K., Pandey, Y., Lathwal, S. S., & Dang, A. K. (2021). Supplementation of antioxidant micronutrients reduces stress and improves immune function/response in periparturient dairy cows and their calves. Journal of Trace Elements in Medicine and Biology, 65, 126718. https://doi.org/10.1016/j.jtemb.2021.126718
Arfuso, F., Giannetto, C., Bazzano, M., Assenza, A., & Piccione, G. (2021). Physiological Correlation between Hypothalamic–Pituitary–Adrenal Axis, Leptin, UCP1 and Lipid Panel in Mares during Late Pregnancy and Early Postpartum Period. Animals, 11(7), 2051. https://doi.org/10.3390/ani11072051
Arfuso, F., Giudice, E., Panzera, M., Rizzo, M., Fazio, F., Piccione, G., & Giannetto, C. (2022). Interleukin-1Ra (Il-1Ra) and serum cortisol level relationship in horse as dynamic adaptive response during physical exercise. Veterinary Immunology and Immunopathology, 243, 110368. https://doi.org/10.1016/j.vetimm.2021.110368
Chase, C. C. L. (2018). Enteric Immunity. Veterinary Clinics of North America: Food Animal Practice, 34(1), 1–18. https://doi.org/10.1016/j.cvfa.2017.10.006
den Hartog, G., Savelkoul, H. F. J., Schoemaker, R., Tijhaar, E., Westphal, A. H., de Ruiter, T., van de Weg-Schrijver, E., & van Neerven, R. J. J. (2011). Modulation of Human Immune Responses by Bovine Interleukin-10. PLoS ONE, 6(3), e18188. https://doi.org/10.1371/journal.pone.0018188
Diez‐Fraile, A., Meyer, E., & Burvenich, C. (2003). Sympathoadrenal and immune system activation during the periparturient period and their association with bovine coliform mastitis. A review. Veterinary Quarterly, 25(1), 31–44. https://doi.org/10.1080/01652176.2003.9695142
ELENKOV, I. J., & CHROUSOS, G. P. (2002). Stress Hormones, Proinflammatory and Antiinflammatory Cytokines, and Autoimmunity. Annals of the New York Academy of Sciences, 966(1), 290–303. https://doi.org/10.1111/j.1749-6632.2002.tb04229.x
Fiore, E., Arfuso, F., Colitti, M., Gianesella, M., Giudice, E., Piccione, G., & Morgante, M. (2017). Expression of selected genes related to energy mobilisation and insulin resistance in dairy cows. Animal Production Science, 57(6), 1007. https://doi.org/10.1071/AN15376
Goff, J. P., & Horst, R. L. (1997). Physiological Changes at Parturition and Their Relationship to Metabolic Disorders. Journal of Dairy Science, 80(7), 1260–1268. https://doi.org/10.3168/jds.S0022-0302(97)76055-7
Gruse, J., Kanitz, E., Weitzel, J. M., Tuchscherer, A., Stefaniak, T., Jawor, P., Wolffram, S., & Hammon, H. M. (2016). Quercetin Feeding in Newborn Dairy Calves Cannot Compensate Colostrum Deprivation: Study on Metabolic, Antioxidative and Inflammatory Traits. PLOS ONE, 11(1), e0146932. https://doi.org/10.1371/journal.pone.0146932
Lopreiato, V., Mezzetti, M., Cattaneo, L., Ferronato, G., Minuti, A., & Trevisi, E. (2020). Role of nutraceuticals during the transition period of dairy cows: a review. Journal of Animal Science and Biotechnology, 11(1), 96. https://doi.org/10.1186/s40104-020-00501-x
Lopreiato, V., Minuti, A., Trimboli, F., Britti, D., Morittu, V. M., Cappelli, F. P., Loor, J. J., & Trevisi, E. (2019). Immunometabolic status and productive performance differences between periparturient Simmental and Holstein dairy cows in response to pegbovigrastim. Journal of Dairy Science, 102(10), 9312–9327. https://doi.org/10.3168/jds.2019-16323
Menge, C., Neufeld, B., Hirt, W., Schmeer, N., Bauerfeind, R., Baljer, G., & Wieler, L. H. (1998). Compensation of preliminary blood phagocyte immaturity in the newborn calf. Veterinary Immunology and Immunopathology, 62(4), 309–321. https://doi.org/10.1016/S0165-2427(98)00109-3
Osorio, Johan. S. (2020). Gut health, stress, and immunity in neonatal dairy calves: the host side of host-pathogen interactions. Journal of Animal Science and Biotechnology, 11(1), 105. https://doi.org/10.1186/s40104-020-00509-3
Regassa, F., & Noakes, D. E. (1999). Acute phase protein response of ewes and the release of PGFM in relation to uterine involution and the presence of intrauterine bacteria. Veterinary Record, 144(18), 502–506. https://doi.org/10.1136/vr.144.18.502
Rice, G. E. (2001). Cytokines and the Initiation of Parturition. In The Endocrinology of Parturition (pp. 113–146). KARGER. https://doi.org/10.1159/000061023
Rogers, A., & Eastell, R. (2001). The effect of 17β-estradiol on production of cytokines in cultures of peripheral blood. Bone, 29(1), 30–34. https://doi.org/10.1016/S8756-3282(01)00468-9
Sadri, H., Getachew, B., Ghaffari, M. H., Hammon, H. M., Steinhoff-Wagner, J., & Sauerwein, H. (2020). Short communication: Plasma concentration and tissue mRNA expression of haptoglobin in neonatal calves. Journal of Dairy Science, 103(7), 6684–6691. https://doi.org/10.3168/jds.2020-18218
Yoshioka, M., Watanabe, A., Shimada, N., Murata, H., Yokomizo, Y., & Nakajima, Y. (2002). Regulation of haptoglobin secretion by recombinant bovine cytokines in primary cultured bovine hepatocytes. Domestic Animal Endocrinology, 23(3), 425–433. https://doi.org/10.1016/S0739-7240(02)00174-1