La lipidosi o steatosi epatica o, in inglese, fatty liver è la malattia metabolica a più alta incidenza nella bovina da latte, ma anche nelle pecore e nelle bufale molto produttive. Questa dismetabolia si riscontra con una più alta frequenza nei soggetti di alto potenziale genetico (HMG) in virtù di una maggiore “prepotenza” metabolica della mammella verso i nutrienti ed una ridotta produzione o sensibilità all’insulina di questi animali. La selezione per una maggiore produzione di latte e di grasso “premia” quei soggetti che producono di più ed hanno una maggiore attitudine a dimagrire nelle prime settimane di lattazione, proprio per mettere a disposizione della mammella la maggiore quantità possibile di acidi grassi. Diete ad alta concentrazione di lipidi somministrate a bovine e bufale gravide in lattazione, animali che arrivano grassi a fine gravidanza e l’acidosi ruminale sub-clinica in “transizione” non fanno che aggravare il rischio di lipidosi epatica.
La difficoltà di diagnosticare questa malattia, se non ricorrendo alle biopsie epatiche e ai profili emato-chimici, rende difficile calcolarne esattamente la prevalenza. Sicuramente il picco d’incidenza si ha nelle prime 4 settimane di lattazione e probabilmente nel 50% delle bovine da latte. Oggi però si è più portati a pensare che l’accumulo patologico di grassi, o meglio di trigliceridi (TAG), sia uno status che accompagna tutta la vita produttiva di molti ruminanti da latte, e maggiormente di quelli HMG.
Ma cos’è la lipidosi epatica e come si sviluppa?
Già prima del parto e nelle prime settimane di lattazione, il fabbisogno energetico dei ruminanti da latte è superiore alla capacità di produrre energia a partire dai nutrienti ingeriti e dai prodotti delle fermentazioni ruminali (acidi grassi volatili e proteina metabolizzabile). Il calo d’insulina risultante innesca una spesso imponente liberazione di acidi grassi dal tessuto adiposo. Questi acidi grassi liberi (anche detti NEFA), ossia non esterificati, vengono trasportati dal sangue al fegato con l’obiettivo di essere ossidati per produrre energia. Per essere utilizzati in questo modo, i NEFA devono entrare nella cellula epatica ed essere “attivamente” trasportati da enzimi “carnitina dipendenti” (carnitina acil tranferasi I e II) all’interno del mitocondrio. Se questo avviene correttamente, gli acidi grassi vengono tutti trasformati in energia chimica (ATP), oppure una parte di essi viene convertita in corpi chetonici (BHBA, acetone e aceto-acetato) che ritornano nel sangue. Quando la presenza di quest’ultimi è molto elevata si definisce chetosi metabolica. La forma sub-clinica si verifica quando una bovina presenta nel sangue una concentrazione di BHBA > 10-12 mg/dl oppure 1-1.2 mmol/L. La forma clinica esibisce una sintomatologia facilmente riconoscibile. Se l’afflusso di NEFA al fegato è eccessivo, o meglio superiore alla possibilità di trasporto degli enzimi “carnitina dipendenti”, essi saranno riesterificati nuovamente nel fegato in trigliceridi e come tali stoccati. Pertanto, tra chetosi e lipidosi epatica esiste una relazione. Se un ruminante da latte ha una concentrazione “patologica” di corpi chetonici nel sangue significa indirettamente che c’è un grande afflusso di acidi grassi al fegato e quindi una probabilità che si accumulino nella cellula epatica molto elevata.
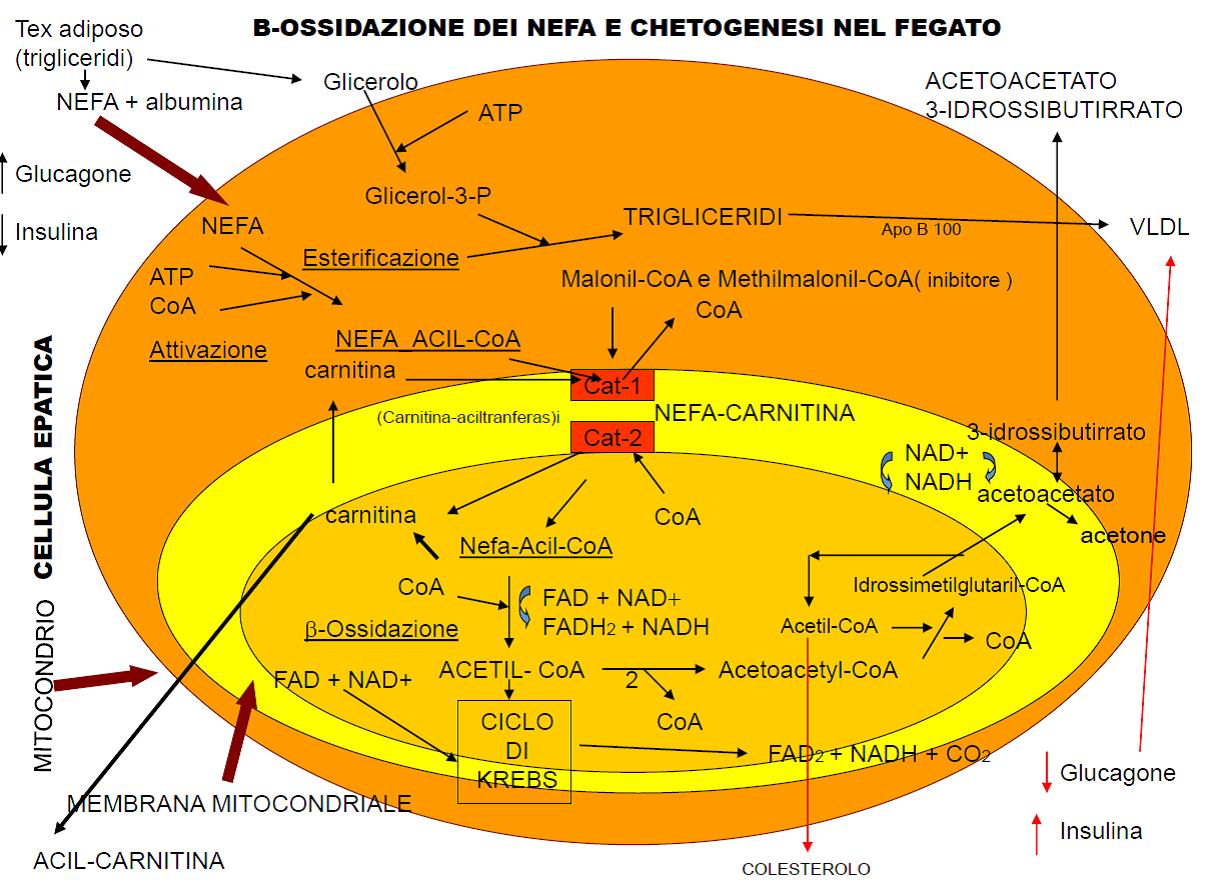
La lipidosi epatica è un’eccessiva concentrazione di TAG nel fegato. Attraverso una biopsia epatica, o in un esame anatomo-patologico post-mortem, si riesce facilmente a diagnosticare questa patologia. E’ definito sano un fegato con meno dell’1% (tal quale) di TAG. Tra l’1 e il 10% viene definita lipidosi epatica di grado medio, e grave se supera il 10%. L’entità della lipomobilizzazione si può facilmente quantificare dosando nel sangue gli acidi grassi non esterificati (NEFA) oppure eseguendo al parto e dopo qualche settimana una valutazione dello stato di nutrizione (BCS). Si ritiene a rischio una bovina da latte che nella settimana che precede il parto e durante il puerperio abbia una concentrazione ematica di NEFA, rispettivamente, > 0.29 meq/L o mmol/L e >0.6 meq/L o mmol/L, oppure se perde di più di 0,5-1 punti di BCS dal parto alla quarta settimana di lattazione. Per quantificare il rischio di lipidosi epatica e anche di chetosi metabolica si può utilizzare come biomarker la concentrazione di grasso nel latte. Una bovina di razza frisona che ha un latte con una concentrazione di grasso > 4.8% nelle prime settimane di lattazione sta presumibilmente mobilizzando una grande quantità di acidi grassi a lunga catena dal tessuto adiposo. La “spettroscopia in trasformata di Fourier” (FTIR) di lettura degli spettri del “medio infrarosso” (MIR) permette rapidamente ed ad un basso costo una misurazione dei vari acidi grassi che compongono il grasso del latte della singola bovina, per capire quale quota di grasso deriva dagli acidi grassi corti prodotti dalle fermentazioni ruminali (da C4:0 a C:14:1 o de novo), da quelli principalmente introdotti dalla dieta (da C16:0 a C17:0 o mixed) e da quelli che derivano dal tessuto adiposo o dalla dieta (C18:0, C18:1 e C18:2). In genere, nel latte bovino gli acidi grassi corti o de novo sono il 18-30%, quelli mixed il 35-40% ed i preformati il 30-35% del grasso totale. Riuscire a capire di che tipo siano gli acidi grassi del sangue non letti genericamente come NEFA aiuta nell’individuazione dei fattori di rischio e nella prevenzione della lipidosi epatica.
Gli esami emato-chimici del sangue possono aiutare a diagnosticare sul singolo soggetto la lipidosi epatica. Per verificare l’integrità delle cellule epatiche sono utili le transaminasi GOT-AST e GPT-ALT, e l’SDH. Per controllare la capacità escretoria si guarda la bilirubina, per l’integrità biliare la AP-GGT e per la funzionalità urea, l’albumina ed il colesterolo totale.
L’eccessivo dimagrimento a fine gravidanza e ad inizio lattazione ed un uso improprio dei grassi nella dieta sono importanti fattori di rischio per la lipidosi epatica. A questi due fattori si associa l’endotossicosi, ossia l’ingresso nel sangue di endotossine provenienti dalla morte dei batteri gram-negativi che può avvenire nel rumine a seguito di acidosi ruminali anche a decorso sub-clinico, dalle metriti o dalle mastiti. Le endotossine stimolano le citochine pro-infiammatorie e sottraggono al fegato molte di quelle lipoproteine necessarie per eliminare, o meglio esportare nel sangue, i trigliceridi che si possono accumulare nelle cellule epatiche.
Ma le “mille sfumature di grigio” della lipidosi epatica quali funzioni epatiche compromettono nello specifico?
Nella lipidosi epatica si riscontra una significativa riduzione nell’epatocita di precursori energetici come i citrati ed il glicogeno, ed un incremento di NEFA, BHBA e acetoacetato. La riduzione delle apoproteine B, della protein-chinasi C e della carnitina palmitoil-tranferasi determina un’ulteriore riduzione della β-ossidazione e della chetogenesi. Nella vacca con lipidosi, anche di lieve entità, si ha una marcata riduzione della produzione degli esteri del colesterolo, importanti precursori della sintesi degli ormoni steroidei come gli estrogeni ed il progesterone. Un epatocita alterato dalla lipidosi eserciterà una ridotta attività gluconeogenica, di clerance dell’insulina e delle endossine. Una riduzione della gluconeogenesi, ossia della possibilità di sintetizzare glucosio dagli AGV ruminali e dalle proteine, aggraverà ulteriormente la situazione in un momento in cui i fabbisogni di glucosio sono molto elevati. La riduzione anche marcata della sintesi dell’urea comporta un innalzamento pericoloso dell’ammoniaca. Tipico è il riscontro di concentrazioni “incoerenti” di urea nel sangue o nel latte e la razione alimentare e lo stadio fisiologico della bovina. Un’alterazione nel meccanismo di sintesi dell’urea comporta pericolosi innalzamenti di ammoniaca di derivazione ruminale o dal metabolismo degli aminoacidi. Per questa ragione la determinazione dell’azoto ureico e dell’urea ematica individuale è entrata nella diagnostica di funzionalità epatica della bovina. Infiltrazioni adipose del pancreas hanno ripercussioni negative sulla sintesi dell’insulina e del glucagone. Molto grave è la riduzione della sintesi epatica di IGF-1, ormone secreto dal fegato sotto la stimolazione del GH, e dell’insulina. Tale ormone è un importante fattore di crescita follicolare essendo presenti recettori sulle cellule della granulosa. L’IGF-1 amplifica la risposta dei recettori follicolari all’LH e stimola la capacità di produrre gli estrogeni ed il progesterone da parte delle cellule della granulosa follicolare. Una bovina con lipidosi epatica vede aumentare l’interparto, ridurre il tasso di gravidanza e soprattutto ritardare la ripresa dell’attività ovarica dopo il parto. Pertanto, la riduzione delle performance riproduttive è legata ad un’alterazione della sintesi e del metabolismo dei principali ormoni sessuali, ad una ridotta disponibilità energetica per l’alterazione della gluconeogenesi ed all’inefficiente meccanismo di detossificazione epatica dell’ammoniaca e delle altre tossine. Molto importante è l’effetto negativo che la lipidosi epatica ha sull’efficienza del sistema immunitario. E’ stato evidenziato ormai da numerose ricerche come questa patologia sia in grado di condizionare l’insorgenza, la durata e l’esito di molte malattie a sfondo infettivo, come ad esempio la mastite e le metrite. Molti aspetti delle risposte immunitarie vengono soppressi durante la lipidosi epatica anche se di lieve entità. Riducendosi la citotossicità, per una minore produzione di molecole ossigeno reattive, viene alterata la capacità e l’efficacia della fagocitosi da parte dei macrofagi e dei neutrofili, elementi cellulari fondamentali dell’immunità innata (cellulo-mediata) della vacca da latte. Si è descritta anche una riduzione della produzione delle immunoglobuline e di interferone da parte dei leucociti e della loro presenza. Nella lipidosi epatica è alterata la capacità della cellula epatica di sintetizzare e degradare le proteine della fase acuta. E’ stato dimostrato sperimentalmente che sia i NEFA che il BHBA possono ridurre le risposte immunitarie e come l’IGF-1 possa, se adeguatamente prodotto, stimolare l’attività dei neutrofili. Di converso è stato comunque dimostrato come un accumulo di proteine della fase acuta possa esacerbare o addirittura causare la lipidosi epatica per l’effetto che hanno sulle apolipoproteine.
Conclusione
La lipidosi epatica è molto diffusa negli allevamenti di ruminanti da latte e soprattutto in quelli dove sono presenti prevalentemente animali di alto potenziale genetico. Per avere performance produttive, riproduttive ed economiche accettabili, il fegato deve essere pienamente efficiente, anche se ciò è piuttosto difficile in quanto il dimagramento nella fase di transizione e nelle prime settimane di lattazione è da considerare fisiologico. Accortezze gestionali e nutrizionali, e l’adozione di specifici additivi, possono dare risultati molto evidenti in allevamento.
MecoVit (R), grazie alla sinergia dei suoi nutrienti fondamentali per il metabolismo epatico della vacca da latte in transizione, riduce il rischio di lipidosi epatica, chetosi ed incidenza delle complicazioni nel post-parto.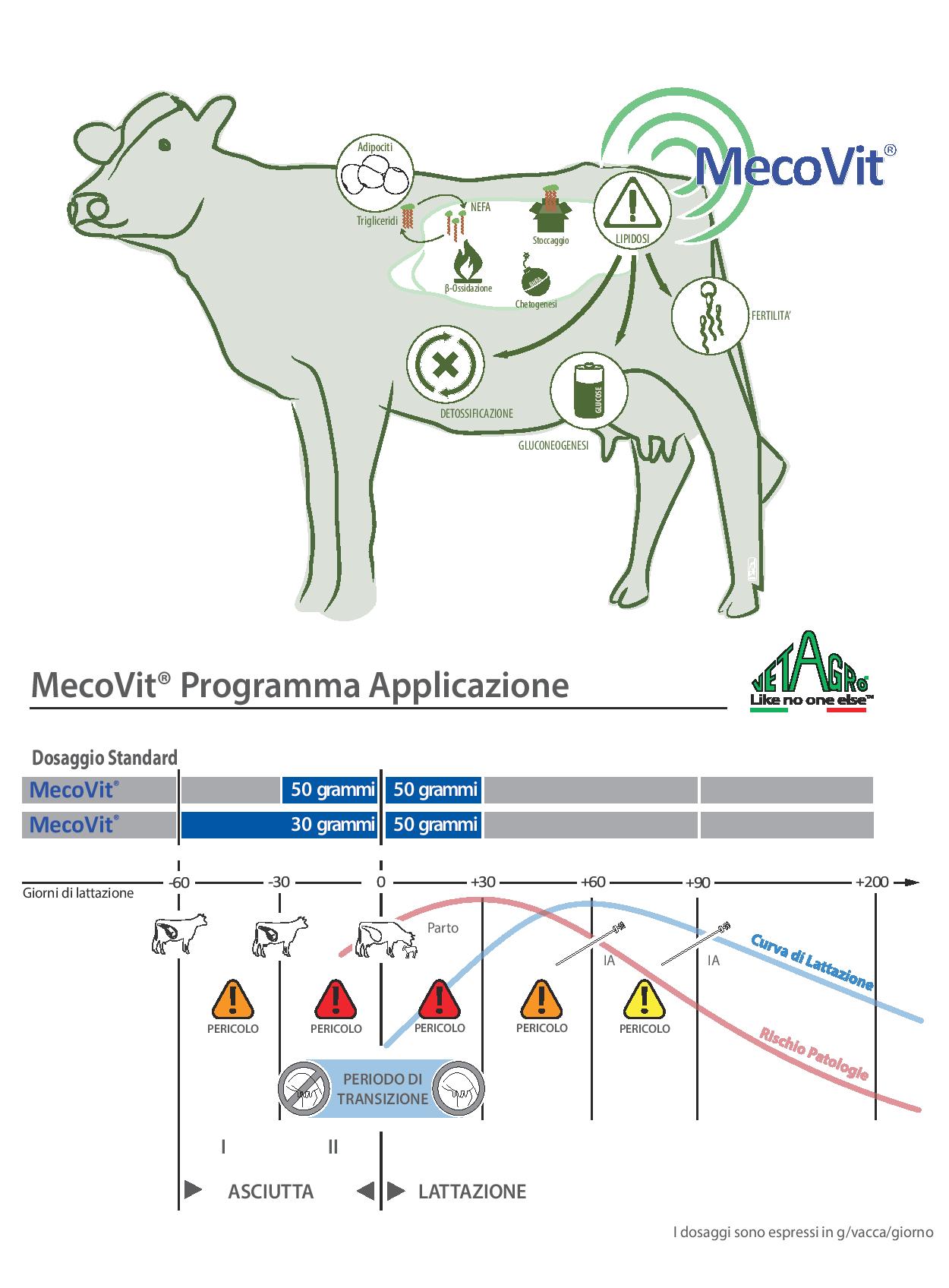
Clicca qui per saperne di più: www.vetagro.com/it/product/mecovit/








































































