Effetti di una dieta ad elevato tenore proteico sulla funzionalità muscolare e cognitiva: uno studio d’intervento dietetico randomizzato controllato in uomini sani
Lene H. Jakobsen a,b,*, Jens Kondrup a,b, Maria Zellner c, Inge Tetens d, Erich Roth c
a Department of Human Nutrition, Faculty of Life Sciences, Università di Copenhagen, Danimarca
b Clinical Nutritional Unit, Rigshospitalet, Danimarca
c Surgical Research, Medical University Vienna, Austria
d Department of Nutrition, National Food Institute, Technical University of Denmark, Danimarca
Ricevuto il 16 Luglio 2010, accettato il 21 Dicembre 2010
Alcune parti di questo lavoro sono state presentate al congresso ESPEN 2008 a Firenze (Italia, P232) e al congresso ESPEN 2009 a Vienna (Austria, P086).
* Autore corrispondente. Clinical Nutritional Unit, Rigshospitalet, Blegdamsvej 9, DK-2100 Copenhagen, Danimarca. Tel.: +45 35 45 81 47; fax: +45 35 45 25 53.
E-mail: lene.holm@rh.regionh.dk (L.H. Jakobsen).
Introduzione
Soggetti e metodi
- Protocollo dello studio
- Dieta
- Misurazioni antropometriche
- Funzionalità muscolare
- Funzionalità cognitiva
- Analisi d’impedenza bioelettrica
- Dispendio energetico
- Qualità della vita (QoL)
- Analisi dei campioni ematici
- Raccolta delle urine
- Assunzione di azoto e bilancio energetico
- Aminoacidi
- Funzionalità muscolare
- Funzione cognitiva e tempo di reazione
- Qualità della vita
- Effetti avversi di una dieta ad elevato tenore proteico
- Limitazioni dello studio
Conclusione
Conflitto di interessi
Riconoscimenti
Bibliografia
Parole chiave: Proteina, Funzionalità muscolare, Funzionalità cognitiva, Aminoacidi plasmatici
Sono state proposte nuove direttive per l’utilizzo di ulteriori criteri oltre il bilancio dell’azoto, per determinare i fabbisogni proteici. Tuttavia, esistono poche prove a sostegno di queste altre misure (come, ad esempio le funzioni fisiologiche).
Obiettivo
Studiare gli effetti di una dieta con tenore proteico normale (UP) rispetto ad una dieta con tenore proteico elevato (HP) sulla funzionalità muscolare, sulla funzione cognitiva, sulla qualità della vita e sui regolatori biochimici del metabolismo proteico.
Disegno
È stato condotto uno studio d’intervento randomizzato su 23 maschi sani (età 19-31 anni). Tutti i soggetti hanno consumato una dieta con contenuto proteico normale (UP) (1.5 g di proteine/kg di peso corporeo) per un periodo di prova della durata di 1 settimana prima del periodo di intervento. Poi sono stati suddivisi in due gruppi ed è stata loro assegnata o una dieta UP o una dieta ad elevato tenore proteico (HP, 3.0 g proteina/kg di peso corporeo) per 3 settimane, che prevedeva un consumo controllato di alimenti e bevande. Sono stati prelevati campioni di sangue e di urina e sono state fatte misurazioni delle funzioni fisiologiche al basale e alla fine del periodo di intervento.
Risultati
Il gruppo con HP ha migliorato significativamente il tempo di reazione rispetto al gruppo UP. Gli amminoacidi a catena ramificata e la fenilalanina nel plasma sono risultati significativamente aumentati nei soggetti che consumavano una dieta HP, cosa che potrebbe spiegare il miglioramento del tempo di reazione.
Conclusione
I maschi giovani sani alimentati con una dieta HP hanno migliorato i loro tempi di reazione. Non sono stati osservati degli effetti avversi attribuibili alla dieta HP.
Questo studio è stato registrato su www.clinicaltrials.govas NCT00621231.
©2010 Elsevier Ltd and European Society for Clinical Nutrition and Metabolism. Tutti i diritti riservati.
Introduzione
Le attuali raccomandazioni WHO/FAO/UNU relative al consumo di proteine si basano su studi del bilancio dell’azoto (N).1 Tuttavia, gli autori auspicano che in futuro i fabbisogni proteici si baseranno su criteri relativi alla “salute e al benessere a lungo termine” anziché sul bilancio dell’azoto. Un numero crescente di studi suggerisce il ruolo positivo svolto dalle proteine nel promuovere una salute ottimale, con livelli di assunzione superiori a quelli previsti dai valori dietetici di riferimento se parliamo, ad esempio, di controllo del peso e di sazietà, di sarcopenia, di omeostasi del glucosio e di salute delle ossa.2 Esistono poche prove, da studi d’intervento, degli effetti di un maggiore apporto proteico sulle performance ottenute in test fisici e mentali relativi alla qualità della vita in soggetti sani. Alcuni studi hanno esaminato gli effetti delle diverse assunzioni proteiche sulle funzioni fisiologiche.3,4 Uno studio che reclutava donne anziane sane, ha dimostrato perdite significative nella risposta immunitaria e nella funzionalità muscolare dopo un periodo di consumo proteico marginale di 9 settimane (0.45 g di proteine/kg di peso corporeo) se confrontato con un consumo proteico adeguato (0.92 g di proteine/kg di peso corporeo).3 Non è stato studiato se l’aumento del tenore proteico nella dieta (superiore a 0.92 g di proteine die/kg di peso corporeo) potesse migliorare ulteriormente le funzioni fisiologiche. Un altro studio indagava l’effetto delle diverse tipologie di carboidrati sulla funzionalità cognitiva, ed ha riscontrato un miglioramento del tempo di reazione dopo il consumo di un pasto ricco di proteine piuttosto che dopo un pasto ricco di carboidrati.4 I possibili effetti del consumo di diete contenenti cibi ricchi di proteine su queste funzioni non erano ancora stati studiati nei giovani maschi sani, che vengono comunemente reclutati come popolazione di riferimento. Lo scopo del nostro studio era quello di analizzare l’effetto del consumo di una dieta con elevato tenore proteico (HP), rispetto ad una dieta con tenore normale di proteine (UP), sulle funzioni fisiologiche, compresa la funzionalità muscolare, la funzionalità cognitiva, i tempi di reazione e la qualità della vita. Il consumo abituale di proteine in Danimarca e negli Stati Uniti è di 1.5 g per kg di peso corporeo.5,6 Inoltre, sono state valutate le perdite di N per dimostrare la conformità del protocollo e per mettere in relazione i nostri risultati con quelli di indagini precedenti. Sono state misurate le concentrazioni ematiche di ormoni e di substrati correlati al turnover proteico, per chiarire i meccanismi alla base dei possibili effetti fisiologici. Il dispendio energetico a riposo, l’attività fisica e la composizione corporea sono stati misurati o registrati per valutare i possibili cambiamenti del bilancio energetico e dello stato nutrizionale, allo scopo di mantenere il peso corporeo stabile durante tutto lo studio. Le diete erano composte principalmente da proteine animali al fine di garantire un apporto proteico di alta qualità.
Soggetti e metodi
Protocollo dello studio
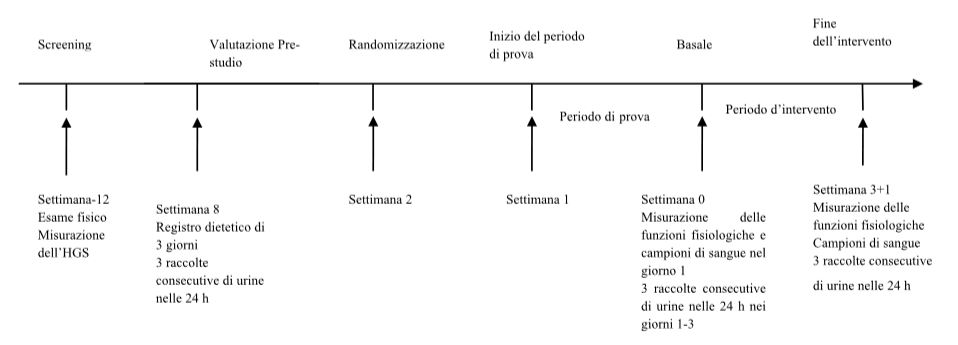
Lo studio era di tipo randomizzato, in cieco, in parallelo e prevedeva un controllo dietetico praticamente completo, condotto in un arco di tempo suddiviso in 3 periodi: una valutazione pre-studio (3 giorni), un periodo di prova (1 settimana) e un periodo d’intervento (3 settimane). (Vedi Fig. 1). I soggetti sono stati reclutati tramite pubblicità in un sito web presso l’Università di Copenaghen. Sono stati inclusi solo i soggetti (di età compresa tra i 20 e i 40 anni) ritenuti in buona salute dopo un esame fisico condotto durante lo screening. I criteri di esclusione erano: fumatore, sovrappeso (BMI ≥ 25), utilizzo di qualsiasi farmaco, esercizio fisico intenso (esercizio fisico intenso > 4 ore/settimana), presenza di qualsiasi malattia cronica e di patologia (o compromissione) della spalla, del braccio e/o della mano. Tutti i soggetti arruolati nello studio avevano pesi stabili al momento dell’inserimento nello studio e sono stati istruiti a rimanere così per tutta la sua durata. Inoltre, ai soggetti è stato detto di non modificare i loro livelli abituali di attività fisica. Il nostro calcolo della potenza (Vedi Statistiche) era basato sulle misurazioni dell’HGS riportate nello studio menzionato in.3 Per avere dei valori basali di riferimento relativi all’HGS confrontabili, i soggetti sono stati stratificati in base all’HGS. L’HGS è stata misurata durante la sessione di screening e il valore medio complessivo ottenuto è stato utilizzato come criterio di stratificazione. Durante la valutazione pre-studio ( durata 3 giorni), ai soggetti è stato chiesto di tenere un registro alimentare pesato dei loro consumi spontanei. Questo è stato convalidato dopo l’analisi di 3 raccolte consecutive di urine giornaliere. Dopo la valutazione pre-studio, è stato calcolato un fabbisogno energetico stimato come media delle registrazioni alimentari e dei fabbisogni energetici calcolati (equazione di Harris-Benedict ×1.757). Le registrazioni alimentari erano anche impiegate per controllare le abitudini dietetiche esagerate e per confermare che i soggetti consumassero una dieta con un contenuto proteico normale. I soggetti sono stati suddivisi in maniera casuale durante un incontro avvenuto 1 settimana prima del periodo di prova. Durante questo incontro i soggetti hanno scelto una busta sigillata ed opaca contenente un foglio di carta con scritta la parola “Rosso” o “Blu” che corrispondevano al gruppo di controllo e a quello d’intervento. Le buste impiegate per la randomizzazione erano suddivise in 2 pile che differenziavano i soggetti più deboli da quelli più forti, rispetto all’HGS medio complessivo. I codici di randomizzazione assegnati erano conservati da un membro dello staff di cucina, che li doveva conoscere per ragioni pratiche. Il codice colore non è stato rivelato ai ricercatori fino a quando lo studio non è stato completato e i risultati sono stati analizzati statisticamente. Lo studio è stato approvato dal comitato etico di ricerca della Capital region of Denmark (numero di accettazione: H-A-2007-0030). Tutti i soggetti hanno firmato un consenso informato scritto.
Fig.1. Linea del tempo dello studio. Le variabili fisiologiche e i campioni di sangue a digiuno sono state misurate/presi al basale e alla fine del periodo d’intervento (settimana 3+1) e al mattino, 12 h dopo l’ultimo pasto contenente in media 26 g e 79 g di proteine nel gruppo UP e nel gruppo HP, rispettivamente. Le urine (3×24h) sono state raccolte durante la valutazione pre-studio, al basale e alla fine del periodo d’intervento
Tabella 1. Caratteristiche dei soggetti (valutazioni pre-studio)
I dati sono presentati come media ± Deviazione Standard. Differenze tra i gruppi valutate con il test t di Student non appaiato.
a Il fabbisogno energetico è stato stimato come media delle registrazioni alimentari nei 3 giorni e dei fabbisogni energetici calcolati (equazione di Harris-Benedict ×1.75, vedere il testo).
b Proteinaeq = Perdite di azoto calcolate da 6.25 × ( Azoto urinario + Azoto fecale + Azoto vario). Vedere testo.
c Nessuna differenza significativa tra i gruppi.
Dieta
I soggetti hanno iniziato il periodo di prova consumando una dieta che forniva loro specifici fabbisogni energetici stimati. La quantità di energia fornita veniva regolata in base alle variazioni di peso corporeo aggiungendo, o sottraendo, in maniera incrementale 0.5 o 1.0 MJ/d. Durante questo periodo della durata di una settimana, tutti i soggetti sono stati mantenuti a dieta con il solito tenore proteico (circa 1.5 g di proteine/kg di peso corporeo).5,6 Immediatamente dopo il periodo di prova, ai soggetti sono state assegnate due diete con diverse quantità di proteine sulla base della precedente randomizzazione (tabelle 2 e 3). Il gruppo di controllo ha continuato la dieta UP (circa 1.5 g di proteine/kg di peso corporeo) mentre il gruppo d’intervento ha ricevuto una dieta HP (circa 3.0 g di proteine /kg di peso corporeo) per un periodo della durata di 3 settimane (periodo d’intervento). La sostituzione isoenergetica dei carboidrati con le proteine è stata ottenuta sostituendo la pasta, il riso, il pane e il succo di frutta presenti nella dieta UP con un quantitativo equivalente di proteine animali (carne magra di manzo, maiale, pollo, latte e formaggio) nella dieta HP. Questa sostituzione ha portato anche a differenze significative nell’assunzione di vitamina D, B2, B6, B12 e di fibra alimentare (tabelle 2 e 3). Durante i periodi di prova e d’intervento, il dipartimento ha fornito ai soggetti reclutati tutti i cibi e le bevande e sono stati istruiti a non consumare nient’altro che acqua e sale. Nei giorni feriali, il pranzo veniva consumato all’interno del dipartimento e sotto supervisione, mentre la cena, gli spuntini, le bevande e la colazione per la mattina successiva venivano forniti giornalmente sotto forma di pacchetto con le istruzioni per la preparazione e per il consumo. Il cibo e le bevande da consumare durante il fine settimana venivano forniti il venerdì. Gli avanzi venivano riportati al dipartimento per la pesatura e la registrazione. Tutti i nutrienti sono stati stimati utilizzando un database nazionale (Dankost3000, National Food Agency).
Tabella 2. Composizione dei cibi proteici (% del consumo totale di proteina)
Tabella 3. Assunzioni con la dieta
I dati sono presentati come media ± Deviazione Standard. Il test t di Student per dati non appaiati è stato utilizzato per confrontare i gruppi
*p < 0.05, **p < 0.01, ***p < 0.001.
aAcido eicosapentaenoico.
bAcido docosaesaenoico.
Misurazioni antropometriche
Tutte le funzioni fisiologiche e i campioni di sangue sono stati misurati la mattina al basale (settimana 0) e la mattina dopo l’ultimo giorno dell’intervento (settimana 3 + 1) (Fig. 1). Lo studio è stato reso cieco per i ricercatori. Il peso corporeo è stato misurato due volte la settimana su una bilancia elettronica (arrotondando a 0.1 kg) con indumenti leggeri e senza scarpe. La stabilizzazione del peso è stata compresa nell’intervallo di1 kg, partendo dal peso corporeo di base. Al basale e alla fine dell’intervento, i soggetti sono stati pesati al mattino dopo l’evacuazione e dopo il digiuno notturno, mentre durante il periodo di prova e d’intervento i soggetti sono stati pesati prima del pranzo. L’altezza è stata misurata con uno stadiometro da parete (arrotondando a 0.5 cm) mentre i soggetti erano a piedi scalzi. Il BMI è stato calcolato come peso corporeo (kg)/altezza2 (m2).
Funzionalità muscolare
L’HGS è stata misurata nella mano destra mediante un dinamometro manuale idraulico Jamar 5030J1 (Sammons Preston Rolyan, Bolingbrook, Illinois, USA) come descritto in Jakobsen et al.8 La resistenza della presa della mano (HGE) e il lavoro della presa della mano (HGW) sono stati misurati con ElectroFluidGraph (Akern, Firenze, Italia) e la mobilità è stata misurata dal test Timed Up and Go (TUG) come descritto in precedenza da Jakobsen et al.8 Per il test dell’HGE , i soggetti sono stati istruiti a premere una maniglia al 65-75% della loro forza massima, il più a lungo possibile. L’HGW è una misura del lavoro totale prodotto durante il test HGE (HGW = 70% HGS × secondi), calcolata come l’area sotto la curva di forza della presa della mano contro il tempo.
Funzionalità cognitiva
La funzionalità cognitiva è stata valutata utilizzando una versione modificata dell’Addenbrooke Cognitive Examination (ACE), che consiste di 6 parti (orientamento, attenzione/concentrazione, fluenza verbale, memoria, linguaggio e funzione visuo spaziale) delle quali orientamento, fluenza verbale e linguaggio si sono dimostrate essere correlate ai test del tempo di reazione applicati in questo studio.9 Il tempo di reazione è stato valutato utilizzando 3 test con vari gradi di complessità (Allerta tonica/fasica, Go/No-Go e Attenzione Sostenuta) provenienti dalla Testbattery for Attentional Performance (TAP), (TAP 2.1, PsyTest, Herzoganrath, Germania). I test sono stati condotti mettendo il partecipante seduto di fronte allo schermo di un computer; il soggetto doveva rispondere agli stimoli visivi premendo con l’indice della mano dominante un pulsante collegato al computer. L’allerta analizza la capacità di un soggetto di reagire e di mantenere un elevato livello di attenzione in previsione di uno stimolo visivo, senza o con un precedente stimolo uditivo di avvertimento, e viene indicata, rispettivamente, come Allerta Tonica e Allerta Fasica. Questo test riflette principalmente la conduttanza o la reattività dei nervi.10 Il test Go/No-Go dura 3 minuti ed analizza la capacità del soggetto di reagire ad alcuni schemi complessi e di non fornire una risposta ad altri schemi complessi piuttosto simili. Esso, oltre alla reattività, richiede un’analisi centrale con soppressione di risposte indesiderate, cioè uno sforzo cognitivo. Anche l’Attenzione Sostenuta è un test di riconoscimento di pattern, ma i pattern sono più facili da riconoscere e il test dura molto più a lungo (15 min). Questo test analizza l’attenzione costante insieme alla (meno rigorosa) analisi centrale attraverso la soppressione di risposte e reattività indesiderate.
Analisi d’impedenza bioelettrica
L’analisi dell’impedenza bioelettrica (BIA) è stata eseguita per studiare possibili cambiamenti nella composizione corporea utilizzando l’Electro-FluidGraph, che applica correnti elettriche alternate di 300 mA a 50 kHz. L’ElectroFluidGraph misura l’impedenza e l’angolo di fase, dai quali vengono poi calcolate resistenza e reattanza insieme a massa magra e a massa grassa corporea.
Dispendio energetico
È stato misurato il dispendio energetico a riposo (REE) per contribuire al mantenimento della stabilità del peso. L’REE è stato valutato mediante calorimetria indiretta utilizzando un cappuccio ventilato come descritto in precedenza da Raben et al.11 Inoltre, è stata valutata l’attività fisica abituale mediante il diario dell’attività di Bouchard come descritto al suo interno8 per valutare se i soggetti mantenessero il loro livello abituale di attività fisica.
Qualità della vita (QoL)
La QoL è stata valutata con il sondaggio Short-Form Health (SF-36)12 composto da 36 domande raggruppate in 8 scale multi-tematiche: funzionalità fisica, percezione del ruolo fisico, vitalità, salute generale, salute mentale, percezione del ruolo emotivo, funzione sociale e dolore corporeo.12 Sono stati utilizzati gli algoritmi di punteggio americani standard, descritti da Ware et al.13. Le scale dell’SF-36 sono state riassunte in due dimensioni: Physical Component Summary (PCS) e Mental Component Summary (MCS). L’SF-36 si è dimostrato valido nel discriminare tra lo stato di salute fisica e lo stato di salute mentale, sia nei test trasversali che in quelli longitudinali13 ed è stato convalidato in una popolazione danese sana.14
Analisi dei campioni ematici
I campioni di sangue a digiuno sono stati prelevati al basale e alla fine del periodo di intervento al mattino, 12 ore dopo l’ultimo pasto contenente, rispettivamente, una media di 26 g di proteine nel gruppo UP e di 79 g di proteine nel gruppo HP (vedi Fig.1). I campioni di sangue sono stati centrifugati immediatamente a 2800 RPM per 15 minuti a 4°C e il plasma è stato conservato a -20°C fino alle successive analisi. Bicarbonato, sodio, potassio, cloruro, lattato, glucosio e amminoacidi (AA) sono stati analizzati nel plasma, mentre, emoglobina, fosfatasi alcalina, creatinina, TSH, T3, T4, IGFBP-3, IGF-1, GH, insulina e urea sono stati analizzati nel siero. Le concentrazioni di glucosio, urea, creatinina e fosfatasi alcalina sono state analizzate in un analizzatore chimico ABX Pentra 400 (Horiba ABX, Montpellier, Francia). L’emoglobina ematica è stata analizzata mediante un analizzatore ematologico (Sysmex, modello KX-21, New Jersey, USA). Campioni di sangue per l’analisi di bicarbonato, lattato, sodio, potassio e cloruro sono stati valutati mediante un analizzatore di gas del sangue (Radiometer ABL 800 Flex, Copenhagen, Danimarca). Campioni di sangue sono stati raccolti per l’analisi di TSH, T3, T4, GH, IGF-1, IGF-1BP, insulina, urea, creatinina e fosfatasi alcalina. Le concentrazioni degli ormoni sono state analizzate mediante un saggio immunometrico chemiluminescente bifasico in fase solida con Immulite 1000 (Siemens, LA, USA). La clearance della creatinina è stata calcolata partendo dalla creatinina nel plasma, dalla creatinina urinaria delle 24 ore e dal volume delle urine. I campioni di sangue per l’analisi degli AA sono stati centrifugati a 2800 g per 10 minuti a 4ºC. Il plasma risultante è stato trasferito in una nuova provetta e centrifugato una seconda volta a 10.000 g per 10 minuti a 4°C. Infine, il plasma così ottenuto è stato trasferito in un’altra provetta e conservato a –80°C fino al momento dell’analisi. Gli AA sono stati analizzati utilizzando una derivatizzazione pre-colonna automatizzata con o–ftalaldeide e come nella separazione con cromatografia liquida ad alta pressione.15
Raccolta delle urine
I soggetti hanno raccolto 3 campioni consecutivi di urina prodotta durante le 24 ore in 3 diverse occasioni durante lo studio (vedere la Fig. 1). La vescica è stata svuotata immediatamente prima di ogni periodo successivo di raccolta nelle 24 ore. L’urina è stata raccolta in contenitori precedentemente pesati. Ai soggetti è stato chiesto di riporre i contenitori in un luogo fresco e buio. Sono stati determinati il volume e la densità di ciascun campione di urina raccolto nelle 24 ore, e i campioni sono stati congelati a -20°C fino ad ulteriori analisi. Durante le raccolte di urine, i soggetti sono stati invitati a consumare compresse di Acido Para Amino Benzoico (PABA) 3 volte al giorno (240 mg/giorno), per verificare l’accuratezza delle raccolte di urina nelle 24 ore.16 Questa accuratezza è stata fissata come riscontro medio del PABA ≥ 90% .16 Le analisi statistiche sono state eseguite con e senza campioni incompleti. I campioni sono stati prelevati per la ricerca del PABA, dell’albumina, della creatinina, dell’urea e dell’azoto. I campioni di urina sono stati analizzati per quanto riguarda il PABA con uno spettrofotometro (Stasar, Gilford Instruments Laboratories Inc., Oberlin, OH, USA). Il contenuto urinario di albumina, creatinina ed urea è stato misurato con l’ABX Pentra 400. Il contenuto urinario di azoto è stato determinato utilizzando un analizzatore Elementar Vario Max CN (Elementar Analysensysteme GmbH, Hanau, Germania). Le perdite urinarie di azoto sono state espresse come equivalenti proteici (proteineq): Proteineq = N × 6. 25 (g di proteina/kg di peso corporeo al giorno) per facilitare il riscontro con l’assunzione di proteine. Il bilancio dell’azoto (N) è stato calcolato secondo la formula:
Bilancio (proteineq) = Assunzione di proteina – 6.25 (Azoto urinario + Azoto fecale + Azoto vario)
L’azoto urinario è stato calcolato a partire dall’azoto perso misurato. La perdita di azoto fecale è stata calcolata come descritto da Price et al.17:
Azoto fecale = Escrezione di azoto fecale endogeno + assunzione di azoto × (1- digeribilità vera)
L’escrezione fecale endogena è risultata pari a 0.075 g di proteineq/kg di peso corporeo per die17 e la digeribilità vera è risultata essere pari a 0.96 analoga ad una dieta mista occidentale.17 La perdita di azoto vario è risultata pari a 0.05 g di proteineq/kg di peso corporeo per die.18
Statistiche
I risultati sono riportati secondo le linee guida CONSORT.19 Tutti i dati sono presentati come media ± S D. Il test t di Student per dati appaiati è stato utilizzato per valutare i cambiamenti all’interno dei gruppi. Il test t di Student per dati non appaiati è stato utilizzato per confrontare i gruppi. I modelli lineari generalizzati (GLM) sono stati utilizzati per valutare le differenze a fine intervento tra i gruppi, corrette per i valori di base.20 Nei modelli GLM, le ipotesi vengono verificate testando i residui per la distribuzione normale e i dati distorti sono stati trasformati mediante log10, che ha prodotto residui distribuiti normalmente. Un livello accettabile di significatività statistica è stato stabilito a p <0.05. L’area sotto la curva è stata calcolata utilizzando GraphPad Prism versione 5.00 per Windows, GraphPad Software, San Diego, California, USA. L’analisi statistica è stata effettuata utilizzando il pacchetto software SAS System per Windows versione 9.1. Il calcolo della potenza era basato sullo studio menzionato in.3 Si è osservato un aumento significativo della HGS di 3.7 ± 3.2 kg (media ± DS) nel gruppo che riceveva un adeguato apporto proteico. Per ottenere una significatività statistica dello stesso incremento di HGS nel gruppo HP, considerando i valori iniziali più alti, con una potenza dell’80% ed un errore di tipo I del 5%, erano necessari dodici soggetti per braccio di studio. Sulla base di questo, nello studio abbiamo mirato a reclutare 26 soggetti, il che ci ha permesso anche di abbandonarne qualcuno. Castaneda et al.3 hanno ottenuto i loro risultati dopo un periodo di 9 settimane, ma noi per motivi pratici abbiamo scelto un periodo della durata di 3 settimane. La potenza si basava su questo studio solo perché al momento della pianificazione, non erano disponibili studi nutrizionali a lungo termine sul tempo di reazione o sulla funzionalità cognitiva.
Risultati
Caratteristiche di base
Il numero di persone esaminate, escluse, assegnate casualmente e ritirate dallo studio è presentato in Fig. 2. Dei 26 soggetti scelti, ventitré hanno completato lo studio. Di conseguenza, i risultati mostrati sono relativi ai 12 soggetti presenti nel gruppo di controllo (UP) e agli 11 soggetti del gruppo d’intervento (HP). Le caratteristiche dei 23 soggetti che hanno completato lo studio sono riassunte nella Tabella 1. Non essendoci ovvie differenze antropometriche o a livello di fabbisogno energetico (Tabella 1), di HGS (Tabella 4), o d’istruzione (il livello medio d’istruzione era la laurea) tra i due gruppi, questo ci indica che i 2 gruppi erano comparabili al livello basale. Ci sono state solamente delle piccole deviazioni in relazione al fabbisogno energetico stimato durante il periodo di prova e quello di intervento.
Fig.2. Diagramma di flusso dei soggetti
Misure di esito
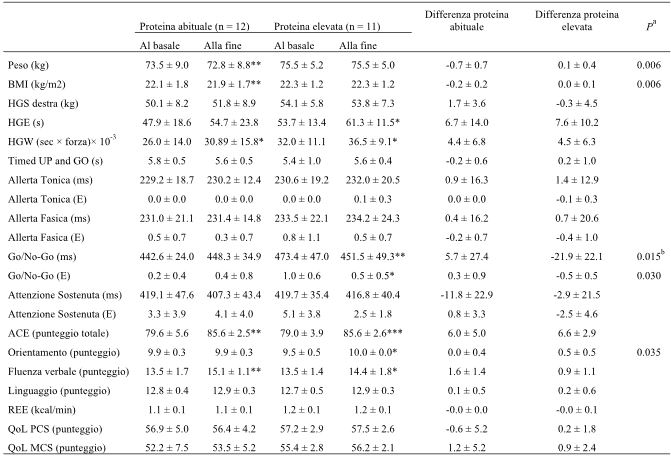
I cambiamenti degli esiti rispetto al basale e le differenze tra i gruppi sono presentati nella Tabella 4. I soggetti dei due gruppi avevano un peso stabile (oscillazioni entro 1 kg) senza cambiamenti nell’attività fisica dichiarata ((stimata come livello di attività fisica): UPbaseline: 1.74 (1.58-1. 83). UPend: 1.62 (1.54-1.90); p = 0.58. HPbaseline: 1.77 (1.59-1.98) HPend: 1.75 (1.54-1.83); p = 0.39.). Non ci sono stati cambiamenti significativi nelle variabili BIA (dati non mostrati). Alla fine dello studio, il gruppo UP aveva subito una significativa diminuzione del proprio peso corporeo e un aumento dei propri punteggi HGW e ACE incluso il punteggio totale e la componente della fluenza verbale. Il gruppo HP aveva aumentato in modo significativo i punteggi di HGE, HGW e ACE tra cui il punteggio totale e la componente relativa all’orientamento e alla fluenza verbale. Inoltre, ha avuto una diminuzione del tempo di reazione e una diminuzione del numero di errori nel test Go/No-Go. I cambiamenti medi nelle componenti dell’ACE come l’orientamento, il tempo di reazione e il numero di errori nel test Go/No-Go erano significativamente maggiori nel gruppo HP rispetto al gruppo UP. La differenza significativa, relativa al tempo di reazione nel test Go/No-Go (ms) tra i gruppi, persisteva dopo aver corretto il valore basale mediante GLM (p = 0.040) (Fig. 3). Il test Go/No-Go (ms) al basale nel gruppo HP era più alto (ma in maniera poco significativa) rispetto a quello del gruppo UP (Tabella 4). Per escludere un errore di regressione lineare, i dati sono stati rianalizzati escludendo i 2 soggetti presenti nel gruppo HG con i livelli basali più elevati, ottenendo un tempo medio di reazione al basale di 459.9 ms nel gruppo HP. Tra i due gruppi rimaneva una differenza significativa tra i valori al basale e quelli a fine intervento (p = 0.031).
Analisi del sangue e delle urine
Non sono state osservate modificazioni significative tra i due gruppi per quanto riguardava i valori dell’emoglobina, della fosfatasi alcalina, della creatinina, del TSH, del T3, del T4, dell’IGFBP-3, dell’IGF-1, del GH, del lattato, dell’insulina, del glucosio, del bicarbonato, del sodio, del potassio, del cloruro e/o dell’albuminuria. Tre su 69 (3×23) raccolte di urine mostravano un recupero medio di PABA < 90% e poiché i risultati non cambiavano nonostante l’esclusione di questi campioni, queste raccolte sono state incluse nei risultati. Alla fine dell’intervento il gruppo HP aveva valori significativamente più elevati di perdite (proteineq) rispetto al gruppo UP (UPend: 1.3 ± 0.2 g/kg di peso corporeo al giorno, HPend: 2.6 ± 0.2 g/kg di peso corporeo al giorno; p <0.001). I soggetti dei due gruppi hanno mantenuto un bilancio proteico positivo per tutta la durata dello studio. La clearance della creatinina e l’albumina contenute nelle urine delle 24 ore non sono cambiate durante lo studio (dati non mostrati).
Tabella 4. Cambiamenti nelle funzioni fisiologiche durante il periodo d’intervento.
I dati sono presentati come media ± Deviazione standard. Abbreviazioni: BMI, indice di massa corporea; Ms: millisecondi; E: numero di errori; HGS: forza della presa della mano; HGE: durata della presa della mano; HGW: lavoro della presa della mano; ACE: test cognitivo di Addenbrooke; REE: bilancio energetico a riposo (kcal/min per soggetto); QoL: qualità della vita; PCS: Sommario della componente fisica; MCS: sommario della componente mentale. Il test t di Student per dati appaiati è stato utilizzato per il confronto tra i gruppi *p < 0.05, **p < 0.01, ***p < 0.001.
a Il test t di Student per dati appaiati è stato utilizzato per il confronto tra i gruppi
b La differenza significativa nel tempo di reazione nel test Go/No-Go tra i gruppi persisteva dopo aver corretto per i valori al basale con GLM ( p = 0.040).
Fig. 3. Effetto della dieta sul tempo di reazione. Effetto significativo ( p = 0.040) della dieta (1.5 versus 3.0 g di proteina/kg di peso corporeo)dopo correzione per i valori al basale mediante un modello di analisi lineare generale. Differenze stimate tra la dieta HP e la dieta UP erano – 25.5 ± 11.6 ms; 95% IC: – 49.7; -1.2 ms.
Aminoacidi
Le variazioni plasmatiche di AA rispetto ai valori al basale e le differenze tra i 2 gruppi sono presentate nella Tabella 5. Al termine dell’intervento, il gruppo UP mostrava un aumento significativo delle concentrazioni di aspartato, glutammato, metionina e triptofano e una diminuzione della concentrazione di istidina. Il gruppo HP mostrava un aumento significativo delle concentrazioni di valina, triptofano, isoleucina, fenilalanina e di AA a catena ramificata (BCAA) e una diminuzione delle concentrazioni di glutammina e glicina rispetto ai valori registrati al basale. Esaminando i 2 gruppi i cambiamenti nei livelli di glutammina, taurina, valina, fenilalanina e BCAA erano significativamente maggiori nel gruppo HP rispetto al gruppo UP. Le differenze significative relative alla valina e ai BCAA persistevano tra i gruppi dopo correzione per i valori basali con GLM (p = 0.0002 e p = 0.013, rispettivamente) (Dati non mostrati).
Tabella 5. Concentrazioni plasmatiche degli aminoacidi al basale e alla fine del periodo d’intervento
I dati sono presentati come media ± Deviazione standard. Il test t di Student per dati appaiati è stato utilizzato per il confronto tra i gruppi *p < 0.05, **p < 0.01, ***p < 0.001.
a Il test t di Student per dati appaiati è stato utilizzato per il confronto tra i gruppi
b Le differenze significative nella valina e nei BCAA totali persistevano tra i gruppi dopo correzione per i valori al basale con GLM (p = 0.0002 e p = 0.013, rispettivamente)
Discussione
In questo studio, la dieta HP ha avuto un effetto positivo sul tempo di reazione dei soggetti sani rispetto alla dieta UP. BCAA e fenilalanina plasmatici sono aumentati in seguito alla dieta HP in concomitanza del miglioramento del tempo di reazione riscontrato sempre in questo gruppo. Non sono stati riscontrati effetti avversi dovuti al consumo di elevate quantità di proteina né un’alterazione della clearance della creatinina né dell’albuminuria.
Assunzione di azoto e bilancio energetico
L’assunzione proteica calcolata a partire dalle perdite di N durante la valutazione pre-studio era compresa nell’intervallo di assunzione proteica standard adottato in Danimarca e negli Stati Uniti5,6 pertanto i soggetti inclusi nello studio sono stati considerati rappresentativi per quanto riguardava il consumo proteico normale. Alla fine dello studio, l’assunzione proteica calcolata dalle perdite di N era significativamente più elevata nel gruppo HP. Se confrontati con l’assunzione riportata, entrambi i gruppi erano apparentemente in bilancio positivo. Ciò concorda con studi precedenti17,21 e si presuppone che sia dovuto ad AA o ad altre sostanze azotate non proteiche che vanno ad accumularsi in risposta ad un consumo elevato di proteine (HP).22,23 Il nostro studio conferma i limiti della tecnica del bilancio azotato come descritta in,24 ma serve comunque per documentare la conformità del regime alimentare. Nessun cambiamento significativo è stato riscontrato per quanto concerne l’REE, l’attività fisica o le variabili delle BIA. È stato dimostrato in precedenza come i pasti ad elevato contenuto proteico possano aumentare la termogenesi indotta dalla dieta per un periodo di 5h.11,25-27 La termogenesi indotta dalla dieta nel gruppo HP apparentemente non durava abbastanza a lungo da avere un effetto sul REE durante il digiuno (approssimativamente 12 ore) o sul peso corporeo ( BW). Entrambi i gruppi hanno ricevuto circa 170 kJ/kg BW per tutta la durata dello studio e ciò ci indica che avevano bisogno della stessa quantità di energia per il mantenimento del peso corporeo. Questi risultati suggeriscono che, durante lo studio, i soggetti erano in bilancio energetico e avevano uno stato nutrizionale inalterato.
Aminoacidi
Le concentrazioni di BCAA e di fenilalanina erano aumentate nel gruppo HP. Questo risultato può essere dovuto ad un non aumento degli enzimi degradanti i BCAA, la fenilalanina e la tirosina, contrariamente a quanto si verifica per la maggior parte degli altri enzimi in grado di scindere gli aminoacidi, che solitamente aumentano durante una dieta HP.28 Quindi, le concentrazioni plasmatiche di questi AA rimanevano elevate dopo l’adattamento ad una dieta HP, mentre le concentrazioni della maggior parte degli altri AA diminuivano verso valori di controllo,28,29 confermando il fatto che le concentrazioni plasmatiche di BCAA, fenilalanina e tirosina erano direttamente proporzionali al consumo di proteine.29
Funzionalità muscolare
Nessun miglioramento è stato misurato in HGS, HGE, HGW o nella mobilità nel gruppo HP se paragonato al gruppo UP. L’aumento della funzionalità muscolare in entrambi i gruppi potrebbe essere considerato un effetto dell’allenamento. Castaneda et al.3 hanno riscontrato una diminuzione significativa dell’HGS in donne sane anziane alimentate con una dieta con contenuto proteico inadeguata (0.45 versus 0.92 g/kg di peso corporeo) dopo un periodo della durata di 9 settimane. Abbiamo analizzato l’effetto di 1.5 e di 3.0 g di proteine/kg di peso corporeo e, almeno con questo intervallo, non abbiamo riscontrato ulteriori miglioramenti in giovani maschi sani durante uno studio condotto per 3 settimane.
Funzione cognitiva e tempo di reazione
Entrambi i gruppi sono migliorati analogamente per quanto riguardava il loro punteggio ACE totale, cosa che probabilmente è legata all’allenamento. Nel gruppo HP, rispetto al gruppo UP, è stato riscontrato un significativo incremento nella componente dell’ACE denominata “orientamento”. In uno studio descrittivo,9 abbiamo riscontrato che le componenti dell’ACE orientamento, fluenza verbale e linguaggio erano correlate al test Go/No-Go. Queste 3 componenti vengono considerate dei processi cognitivi di base, che fungono da elementi basilari per lo sviluppo di capacità intellettuali superiori.30 Nel gruppo HP è stato riscontrato un significativo miglioramento nel tempo di reazione (test Go/No-Go), rispetto al gruppo UP. In precedenza, si è visto che il test Go/No-Go risultava sensibile all’integrazione con acidi grassi omega-3.10 L’Attenzione riflette principalmente la velocità della conduzione nervosa.10 L’elaborazione delle informazioni richiesta nell’Attenzione Sostenuta è meno impegnativa rispetto a quella del test Go/No –Go, ecco il perché di quel tempo di reazione leggermente più lungo nel test Go/No-Go rispetto a quello per l’Attenzione Sostenuta. Pertanto, la dieta HP sembrerebbe avere un effetto positivo sull’elaborazione centrale in test impegnativi ma nessun effetto nei test meno impegnativi, caratterizzati da attività più semplici e di maggiore durata (Allerta e Attenzione Sostenuta). Diversi studi hanno indagato l’effetto dei singoli pasti sui tempi di reazione. Fischer et al.31 hanno analizzato i pasti di prova sia con carboidrati, che con proteine o grassi puri ed hanno scoperto che l’ingestione di proteine portava ad un miglioramento dei tempi di reazione in attività complesse (ma non in quelle semplici), mentre l’ingestione di carboidrati puri rallentava il tempo di reazione.31 Fischer et al.4 e Smith et al.32 hanno studiato l’effetto di pasti ad elevato contenuto di carboidrati o di proteine su tempi di reazione complessi, ed hanno riscontrato un miglioramento del tempo di reazione dopo l’assunzione di un pasto ad elevato tenore proteico anziché dopo un pasto ricco di carboidrati. Nel nostro studio, il miglioramento del tempo di reazione nel gruppo HP potrebbe essere spiegato dalle maggiori concentrazioni di fenilalanina e di tirosina rispetto al gruppo UP. La fenilalanina è un precursore della tirosina, dalla quale vengono sintetizzati i neurotrasmettitori dopamina e norepinefrina. Il tasso di sintesi e di rilascio di questi neurotrasmettitori viene modificato dalle concentrazioni cerebrali dei loro precursori aminoacidici che, a loro volta, vengono influenzate dalla disponibilità ematica.33 È stato dimostrato che un’integrazione di tirosina migliora il tempo di reazione complesso in soggetti esposti a condizioni stressanti.34 L’aumento dei valori di valina e di BCAA totali nel gruppo HP potrebbe contribuire anche al miglioramento del tempo di reazione. Negli studi sui ratti, l’aumento di BCAA nel cervello si ha con l’assunzione di proteine, e la valina risulta essere aumentata più della leucina e dell’isoleucina.35 È noto che i BCAA riducono l’affaticamento e migliorano i test della funzione mentale dopo l’esercizio intenso.36 Ciò sembra che avvenga attraverso l’inibizione dell’assorbimento cerebrale del triptofano e la conseguente riduzione della sintesi del neurotrasmettitore inibitore 5-idrossitriptamina, ma poterebbero essere coinvolte anche altre modalità d’azione. I BCAA possono agire da soli come neurotrasmettitori oppure potrebbero essere convertiti in metaboliti (ancora) non identificati che funzionerebbero come neurotrasmettitori eccitatori.36 Il gruppo HP aveva un’assunzione significativamente maggiore di vitamina D, B2, B6 e B12 rispetto al gruppo UP. È stato dimostrato come le vitamine del gruppo B (acido folico, vitamine B6 e B12) siano in grado di migliorare la funzione cognitiva in soggetti anziani sani sottoposti ad integrazioni con mega dosi di questi elementi (corrispondenti al 375%, 600% e 5357% della DRI) per 5 settimane, ed in pazienti anziani con problemi della funzione cognitiva sottoposti ad integrazione con quantità moderate di vitamine ed oligoelementi per almeno 1 anno.37 Non è stato studiato l’effetto di un maggiore apporto di vitamine del gruppo B sui tempi di reazione. Non si può escludere che un eccessivo consumo di vitamine B6 e B12 possa aver contribuito ad un miglioramento del tempo di reazione. Inoltre, anziché l’aumento dell’apporto proteico, la diminuzione del consumo di carboidrati potrebbe aver contribuito ad un miglioramento del tempo di reazione. Tuttavia, le maggiori concentrazioni di BCAA e di fenilalanina rendono più probabile il ruolo giocato dall’aumento dell’apporto proteico. Inoltre anche la piccola (0.7 kg), ma significativa, perdita di peso nel gruppo UP potrebbe aver contribuito alla differenza finale tra i gruppi, ma siccome tale differenza era dovuta ad un miglioramento nel gruppo HP piuttosto che ad un peggioramento nel gruppo UP, questa è non la spiegazione più probabile. Inoltre, non si può escludere che il miglioramento del tempo di reazione sia il risultato di confronti multipli. Con p = 0.015 nel test Go/No-Go, secondo la correzione di Bonferroni sono consentiti soltanto 3 confronti per diventare non significativi. Tuttavia, i cambiamenti nel tempo di reazione e nella cognizione (ms, E, Orientamento) uniti ad un aumento delle concentrazioni di BCAA e di fenilalanina (insieme agli studi precedenti condotti sui pasti e discussi sopra) non rendono i bias dovuti a confronti multipli l’interpretazione più probabile dei nostri risultati.
Qualità della vita
In nessuno dei gruppi di intervento è stato riscontrato qualche cambiamento nelle scale singole di QoL o nelle componenti riassuntive, PCS ed MCS. I nostri risultati indicano che i miglioramenti del tempo di reazione nel test Go/No-Go, o dell’”Orientamento” nel test della funzionalità cognitiva, non hanno favorito la QoL negli individui che avevano punteggi di base elevati in PCS e MCS.
Effetti avversi di una dieta ad elevato tenore proteico
Nel presente studio non sono stati osservati effetti avversi della dieta HP. L’assunzione elevata di proteine (HP) ha aumentato significativamente le concentrazioni di urea sierica verso la parte superiore del range normale ed ha aumentato anche l’escrezione di N, urea e creatinina con le urine, ma non ha alterato la clearance della creatinina o l’albuminuria. Questo concorda con quanto riportato in.39 Non c’è stato alcun cambiamento relativo ai bicarbonati nel gruppo HP e ciò ci suggerisce che non c’è stato alcun accumulo di acidi. Non abbiamo evidenziato effetti dovuti alla dieta sulle concentrazioni di insulina o di IGF-1. Né le concentrazioni di TSH né quelle di T3 sono cambiate con l’assunzione di proteine derivate dagli alimenti, e questo concorda con quanto riportato in.40
Limitazioni dello studio
Questo studio presenta comunque alcune limitazioni. La dimensione del campione era relativamente piccola e non c’era la sensibilità adatta a rilevare i più lievi cambiamenti. Per poter generalizzare i nostri risultati, è essenziale condurre uno studio con un maggior numero di soggetti. I maschi giovani e sani sembrano essere meno sensibili allo studio d’intervento nutrizionale rispetto agli anziani, alle donne41 o agli individui sottoposti a stress.42 Pertanto, gli effetti osservati potrebbero apparire più marcati nelle popolazioni più anziane, vulnerabili o malnutrite43.
Conclusione
Il tempo di reazione nei maschi giovani e sani è migliorato quando erano sottoposti a dieta con HP per 3 settimane. Gli effetti potrebbero essere spiegati dal concomitante aumento dei livelli plasmatici di BCAA e di fenilalanina. Non sono stati osservati effetti avversi dopo l’adozione della dieta HP.
Conflitto di interessi
Gli autori non hanno ricevuto alcun finanziamento e non hanno altri rapporti che potrebbero portare ad un conflitto di interessi.
Riconoscimenti
La Danish Meat Association ha patrocinato questo studio. Akern/RJL Systems (Firenze, Italia) ha promosso l’ElectroFluidGraph (EFG). Gli sponsor dello studio non sono stati coinvolti nella sua progettazione, nella raccolta, nell’analisi o nell’interpretazione dei dati, nella stesura del manoscritto o nella decisione di presentarlo per la pubblicazione. Gli autori desiderano ringraziare lo staff del Department of Human Nutrition, Faculty of LIFE Sciences, dell’Università di Copenaghen, Danimarca, per l’eccellente aiuto fornito dagli assistenti di ricerca, Janice Marie Sorensen, Fatma Ahmad Shaker Al-Abaiji e Ingeborg Krarup Rask; dagli assistenti di laboratorio, Soren Andresen, Kristina Moller Kristensen e John Gargul Lind; dal personale di cucina, Kira Holst Bjerre Hamann, Karina Graff Rossen e Charlotte Kostecki; dai dietologi Bettina Belmann Mirasola, e Hanne Mary Jensen. Inoltre, desideriamo ringraziare Rita Babeluk, Surgical Research, Medical University Vienna, Austria, per l’eccellente assistenza di laboratorio. LHJ ha condotto lo studio, eseguito l’analisi statistica e redatto il manoscritto. JK ed IT hanno concepito lo studio, partecipato alla sua progettazione e aiutato con la stesura del manoscritto. MZ e ER erano responsabili dell’analisi condotta sugli aminoacidi plasmatici ed hanno contribuito alla stesura del manoscritto. Tutti gli autori hanno letto ed approvato il manoscritto finale.
Bibliografia
- World Health Organization. Protein and amino acid requirements in human nutrition: report of a joint WHO/FAO/UNU expert consultation. Geneva, World Health Organization technical report series, no. 935; 2007.
- Rodriguez NR, Garlick PJ. Introduction to Protein Summit 2007: exploring the impact of high-quality protein on optimal health. Am J Clin Nutr 2008;87: 1551S-3S.
- Castaneda C, Charnley JM, Evans WJ, Crim MC. Elderly women accommodate to a low-protein diet with losses of body cell mass, muscle function, and immune response. Am J Clin Nutr 1995;62:30-9.
- Fischer K, Colombani PC, Langhans W, Wenk C. Carbohydrate to protein ratio in food and cognitive performance in the morning. Phys Behav 2002;75:411-23.
- Fulgoni III VL. Current protein intake in America: analysis of the National Health and Nutrition Examination Survey, 2003e2004. Am J Clin Nutr 2008;87:1554S-7S.
- Pedersen AN, Fagt S, Groth MV, Christensen T, Biltoft-Jensen A, Matthiessen J, et al. Dietary habits in Denmark 2003e2008. 1st ed. Soeborg, Denmark: National Food Institute Technical University of Denmark; 2010.
- World Health Organization. Energy and protein requirements: report of a joint FAO/WHO expert consultation. Geneva: World Health Organization; 1985.
- Jakobsen LH, Rask IK, Kondrup J. Validation of handgrip strength and endurance as a measure of physical function and quality of life in healthy subjects and patients. Nutrition 2010;26:542-50.
- Jakobsen LH, Sorensen JM, Rask IK, Jensen BS, Kondrup J. Validation of reaction time as a measure of cognitive function and quality of life in healthy subjects and patients. Nutrition, in press.
- Fontani G, Corradeschi F, Felici A, Alfatti F, Migliorini S, Lodi L. Cognitive and physiological effects of omega-3 polyunsaturated fatty acid supplementation in healthy subjects. Eur J Clin Invest 2005;35:691-9.
- Raben A, Agerholm-Larsen L, Flint A, Holst JJ, Astrup A. Meals with similar energy densities but rich in protein, fat, carbohydrate, or alcohol have different effects on energy expenditure and substrate metabolism but not on appetite and energy intake. Am J Clin Nutr 2003;77:91-100.
- Ware JE, Kosinski M, Bjorner JB, Turner-Bowker DM, Gandek B, Maruish Mark E. User’s manual for the SF-36v2 health Survey. Lincoln, RI: Quality Metric Incorporated.; 2007.
- Ware JE, Gandek B, Kosinski M, Aaronson NK, Apolone G, Brazier J, et al. The equivalence of SF-36 summary health scores estimated using standard and country specific algorithms in 10 countries: results from the IQOLA Project. J Clin Epidemiol 1998;51:1167-70.
- Bjorner JB, Damsgaard MT, Watt T, Groenvold M. Tests of data quality, scaling assumptions, and reliability of the Danish SF-36. J Clin Epidemiol 1998;51: 1001-11.
- Spittler A, Sautner T, Gornikiewicz A, Manhart N, Oehler R, Bergmann M, et al. Postoperative glycyl-glutamine infusion reduces immunosuppression: partial prevention of the surgery induced decrease in HLA-DR expression on monocytes. Clin Nutr 2001;20:37-42.
- Bingham SA. Urine nitrogen as a biomarker for the validation of dietary protein intake. J Nutr 2003;133(Suppl. 3):921S-4S.
- Price GM, Halliday D, Pacy PJ, Quevedo MR, Millward DJ. Nitrogen homeostasis in man: influence of protein intake on the amplitude of diurnal cycling of body nitrogen. Clin Sci (Lond) 1994;86:91-102.
- Rand WM, Pellett PL, Young VR. Meta-analysis of nitrogen balance studies for estimating protein requirements in healthy adults. Am J Clin Nutr 2003;77: 109-27.
- Moher D, Schulz KF, Altman D. The CONSORT Statement: revised recommendations for improving the quality of reports of parallel-group randomized trials 2001. Explore (NY) 2005;1:40-5.
- Van Breukelen GJ. ANCOVA versus change from baseline: more power in randomized studies, more bias in nonrandomized studies [corrected]. J Clin Epidemiol 2006;59:920-5.
- Cheng AH, Gomez A, Bergan JG, Lee TC, Monckeberg F, Chichester CO. Comparative nitrogen balance study between young and aged adults using three levels of protein intake from a combination wheat-soy-milk mixture. Am J Clin Nutr 1978;31:12-22.
- Fisher H, Brush MK, Griminger P, Sostman ER. Nitrogen retention in adult man: a possible factor in protein requirements. Am J Clin Nutr 1967;20:927-34.
- Garlick PJ, McNurlan MA, Patlak CS. Adaptation of protein metabolism in relation to limits to high dietary protein intake. Eur J Clin Nutr 1999;53(Suppl. 1): S34-43.
- Millward DJ. Metabolic demands for amino acids and the human dietary requirement: Millward and rRvers (1988) revisited. J Nutr 1998;128:2563Se76S.
- Johnston CS, Day CS, Swan PD. Postprandial thermogenesis is increased 100% on a high-protein, low-fat diet versus a high-carbohydrate, low-fat diet in healthy, young women. J Am Coll Nutr 2002;21:55-61.
- Mikkelsen PB, Toubro S, Astrup A. Effect of fat-reduced diets on 24-h energy expenditure: comparisons between animal protein, vegetable protein, and carbohydrate. Am J Clin Nutr 2000;72:1135-41.
- Westerterp KR, Wilson SA, Rolland V. Diet induced thermogenesis measured over 24 h in a respiration chamber: effect of diet composition. Int J Obes Relat Metab Disord 1999;23:287-92.
- Harper AE, Miller RH, Block KP. Branched-chain amino acid metabolism. Annu Rev Nutr 1984;4:409-54.
- Harper AE, Peters JC. Protein intake, brain amino acid and serotonin concentrations and protein self-selection. J Nutr 1989;119:677-89.
- Strub RL, Black FW. The mental status examination in neurology. 2nd ed. Davis: Philadelphia, F.A; 1985.
- Fischer K, Colombani PC, Langhans W, Wenk C. Cognitive performance and its relationship with postprandial metabolic changes after ingestion of different macronutrients in the morning. Br J Nutr 2001;85:393-405.
- Smith A, Leekam S, Ralph A, Mcneill G. The influence of meal composition on post-lunch changes in performance efficiency and mood. Appetite 1988;10:195-203.
- Fernstrom JD, Fernstrom MH. Tyrosine, phenylalanine, and catecholamine synthesis and function in the brain. J Nutr 2007;137:1539S-47S.
- Banderet LE, Lieberman HR. Treatment with tyrosine, a neurotransmitter precursor, reduces environmental stress in humans. Brain Res Bull 1989;22: 759-62.
- Gustafson JM, Dodds SJ, Burgus RC, Mercer LP. Prediction of brain and serum free amino acid profiles in rats fed graded levels of protein. J Nutr 1986;116: 1667-81.
- Newsholme EA, Blomstrand E. Branched-chain amino acids and central fatigue. J Nutr 2006;136:274S-6S.
- Manders M, de Groot LCPG, van Staveren WA, Wouters-Wesseling W, Mulders AJMJ, Schols JMGA, et al. Effectiveness of nutritional supplements on cognitive functioning in elderly persons: a systematic review. J Gerontol A Biol Sci Med Sci 2004;59:1041-9.
- Ware JE, Kosinski M, Gandek B, Aaronson NK, Apolone G, Bech P, et al. The factor structure of the SF-36 health survey in 10 countries: results from the IQOLA Project. J Clin Epidemiol 1998;51:1159-65.
- Skov AR, Toubro S, Bulow J, Krabbe K, Parving HH, Astrup A. Changes in renal function during weight loss induced by high vs low-protein low-fat diets in overweight subjects. Int J Obes Relat Metab Disord 1999;23:1170-7.
- Pacy PJ, Price GM, Halliday D, Quevedo MR, Millward DJ. Nitrogen homeostasis in man: the diurnal responses of protein synthesis and degradation and amino acid oxidation to diets with increasing protein intakes. Clin Sci (Lond) 1994;86:103-16.
- Spring B, Maller O, Wurtman J, Digman L, Cozolino L. Effects of protein and carbohydrate meals on mood and performance: interactions with sex and age. J Psychiatr Res 1982;17:155-67.
- Markus CR, Panhuysen G, Tuiten A, Koppeschaar H, Fekkes D, Peters ML. Does carbohydrate-rich, protein-poor food prevent a deterioration of mood and cognitive performance of stress-prone subjects when subjected to a stressful task? Appetite 1998;31:49-65.
- Pollitt E, Cueto S, Jacoby ER. Fasting and cognition in well- and undernourished schoolchildren: a review of three experimental studies. Am J Clin Nutr 1998;67:779S-84S.
DOI:10.1016/j.clnu.2010.12.010