L’obiettivo della produzione di insilato è quello di ottenere un alimento stabile con un elevato recupero di sostanza secca, di energia e di nutrienti altamente digeribili rispetto alle colture fresche. La fermentazione microbica nel silo produce una serie di prodotti finali e può modificare molti aspetti nutrizionali di un foraggio. Un insilato di alta qualità deve essere privo di composti indesiderati che potrebbero influire negativamente sulle performance degli animali, sull’ambiente o sul guadagno netto dell’azienda.
In questa review pubblicata sul Journal of Dairy Science viene approfondita l’interpretazione dei comuni prodotti finali della fermentazione, le popolazioni microbiche, le proprietà organolettiche e i cambiamenti negli aspetti nutrizionali degli insilati durante lo stoccaggio.
Di seguito, riportiamo la traduzione integrale del lavoro che può essere consultata nella sua interezza o scegliendo, attraverso l’indice qui sotto, i paragrafi di maggiore interesse (la bibliografia è disponibile nell’articolo originale).
INDICE
Interpretazione dei dati provenienti dalle analisi chimiche e microbiologiche degli insilati
- Ph e acido lattico dell’insilato
- Acidi volatili
- Alcoli ed esteri
- Rapporto acido lattico:acido acetico
- N solubile e N ammoniacale
- Popolazione microbica
Caratteristiche organolettiche delle fermentazioni dell’insilato
Effetti del tempo di insilamento sulla fermentazione dell’insilato
Potenziali problematiche ambientali causate dei prodotti finali della fermentazione degli insilati
Introduzione
In assenza di aria, la fermentazione dei carboidrati solubili nei foraggi si traduce in una varietà di prodotti finali che, in ultimo portano, alla conservazione di una coltura foraggera come insilato. La misurazione del pH e la quantificazione della produzione di acidi organici e alcoli sono i fondamenti per valutare le fermentazioni degli insilati. Quando ritenuto necessario, altri componenti comunemente quantificati negli insilati sono le micotossine e una varietà di composti azotati. Le caratteristiche organolettiche possono essere utilizzate per valutare la qualità dell’insilato perché la natura volatile di molti prodotti finali della fermentazione produce una varietà di odori caratteristici. Cherney e Cherney (2003) forniscono un riepilogo dettagliato delle metodiche di laboratorio utilizzate per valutare la qualità dell’insilato. In linea generale, sebbene si ritenga che i processi chimici che si verificano in un silo raggiungano rapidamente uno stato stazionario dopo alcune settimane di fermentazione, è chiaro che piccoli ma significativi cambiamenti in alcuni componenti continuano a verificarsi per mesi e tali processi possono influire sulla qualità dell’insilato. In generale, i dati delle analisi di fermentazione degli insilati possono essere utilizzati per determinare se si è verificata una fermentazione eccellente, media o scadente. Sulla base di queste analisi, è possibile formulare ipotesi plausibili che possono essere utilizzate per spiegare vari risultati. Ad esempio, la fermentazione che una coltura subisce spesso può essere spiegata da fattori come il contenuto di umidità, la capacità tampone, il contenuto di zucchero e le tipologie di organismi che hanno dominato il processo. Anche fattori di gestione come la velocità di compattamento della massa, la densità della massa vegetale insilata, il tipo di additivo utilizzato, la lunghezza del taglio, la gestione della copertura e la gestione del silo durante il processo di desilamento possono influenzare la fermentazione dell’insilato e, successivamente, la sua qualità. In alcuni casi, le analisi qualitative della fermentazione possono spiegare uno scarso valore nutrizionale o una bassa ingestione. Il modo migliore per valutare la qualità dell’insilato è campionarlo in modo corretto e richiedere analisi sulla fermentazione e nutrizionali a un laboratorio di analisi autorizzato. Cherney e Cherney (2003) forniscono raccomandazioni per la raccolta e la spedizione di campioni di foraggio ai laboratori di analisi. Il nostro obiettivo era quello di esaminare le più comuni proprietà chimiche, microbiche e organolettiche degli insilati e i fattori che le influenzano in relazione all’efficienza della fermentazione degli insilati, alla stabilità aerobia, al valore nutrizionale, alle performance degli animali e ai potenziali effetti sull’ambiente, con particolare attenzione al punto di vista nordamericano.
Interpretazione dei dati provenienti dalle analisi chimiche e microbiologiche degli insilati
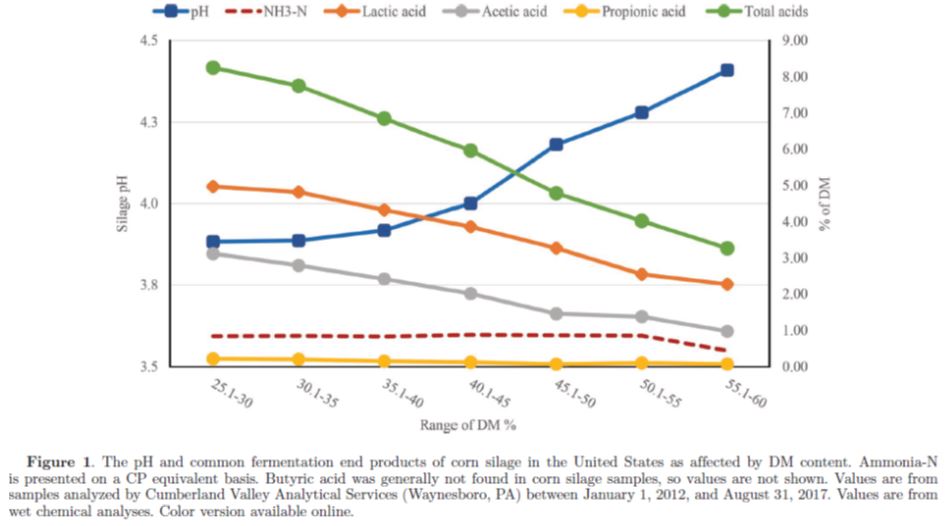
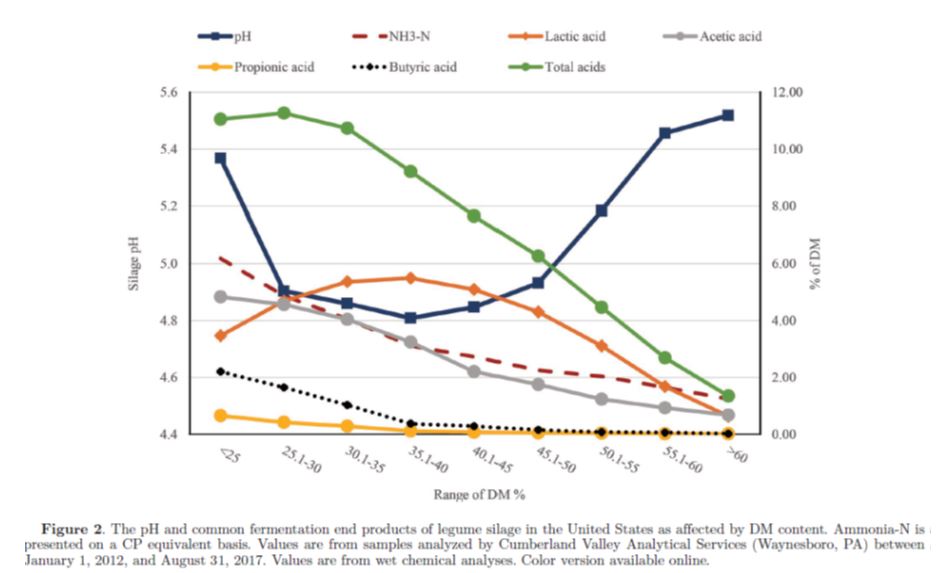
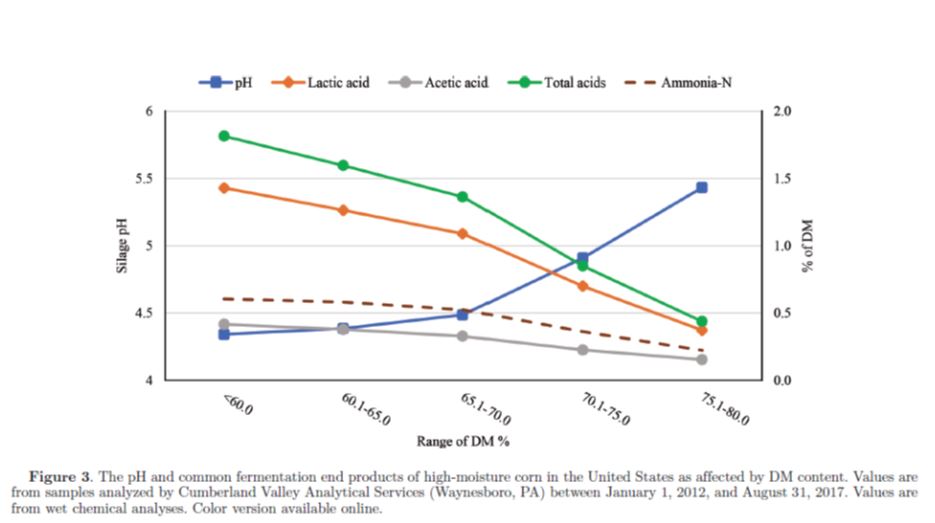
I parametri più comuni utilizzati per valutare la fermentazione degli insilati includono il pH; le concentrazioni di acidi organici, alcoli e NH3-N; e l’entità delle diverse popolazioni microbiche. Nel corso di una fermentazione ideale, i batteri lattici omofermentanti utilizzano carboidrati idrosolubili (ad es. glucosio) per la loro crescita e producono solamente acido lattico, con conseguente recupero relativamente elevato di SS e di energia (Pahlow et al., 2003). Tuttavia, la fermentazione delle colture foraggere è molto complessa e coinvolge numerose tipologie di microrganismi, con conseguente variabilità dei diversi prodotti finali. La Tabella 1 mostra i valori tipici raccomandati per i comuni prodotti finali della fermentazione delle principali tipologie di insilato negli Stati Uniti (Kung e Shaver, 2001). Le figure 1, 2 e 3 mostrano gli andamenti nelle concentrazioni di questi prodotti finali in base alla SS della coltura per insilati di mais, insilati di leguminose e per insilati di mais ad elevato contenuto di umidità (HMC). I valori in queste figure devono essere presi in considerazione con cautela perché molti insilati inviati per le analisi sono “campioni problematici” ed esiste la possibilità che i campioni vengano compromessi durante la spedizione al laboratorio, cosa che potrebbe far sì che le analisi non riflettano realmente la composizione del campione in allevamento. Ad esempio, non tutti gli insilati di leguminose al di sotto del 30% di SS contengono clostridi, come mostrato nella Figura 2; tuttavia, la probabilità che ciò accada è sicuramente maggiore dato che il contenuto di umidità è molto elevato in questi insilati.
Ph e acido lattico dell’insilato
Il pH di un campione insilato è la misura della sua acidità. Il mais (pianta intera) e l’erba medica (le principali colture foraggere per le vacche da latte negli Stati Uniti) hanno livelli di pH che vanno da 5.5 circa a 6 subito dopo il taglio. Durante l’insilamento, l’acido lattico (pKa di 3.86) prodotto dai batteri lattici (LAB), è solitamente l’acido che si ritrova in maggiore concentrazione e contribuisce in larga parte all’abbassamento del pH durante la fermentazione perché è all’incirca 10-12 volte più forte di qualsiasi altro acido principale [ad es. acido acetico (pKa di 4,75) e acido propionico (pKa di 4,87)] presente negli insilati. Le concentrazioni tipiche di acido lattico negli insilati comunemente somministrati agli animali vanno dal 2 al 4% della SS ma possono essere considerevolmente più elevate negli insilati con basse concentrazioni di SS (<30%; Tabella 1). In normali modalità di alimentazione, l’acido lattico dell’insilato viene convertito in acido propionico nel rumine. Il pH finale dell’insilato viene influenzato da molti fattori, ma è principalmente correlato alla concentrazione di acido lattico e alla capacità tampone della coltura. Gli insilati di mais hanno un pH finale inferiore (3.7–4.0) rispetto agli insilati di leguminose (4.3–5.0; Tabella 1) perché hanno una capacità tampone più bassa (capacità tampone di 200–250 mE/kg di SS per il mais e 500–550 mE/kg di SS per le leguminose; McDonald et al., 1991). Nelle figure 1 e 2, il pH dell’insilato è al minimo negli insilati di mais e negli insilati di leguminose al 30-35% circa della SS. Il basso pH dell’acido lattico stabilizza la fermentazione dell’insilato inibendo la crescita o uccidendo i microrganismi che non tollerano un basso pH. Tuttavia, quando la SS aumenta oltre il 40-45%, il pH dell’insilato aumenta. Ciò si verifica perché l’acqua metabolica disponibile per la crescita dei batteri lattici inizia a diventare limitante nel momento in cui aumenta la sostanza secca dell’insilato (Whiter e Kung, 2001). Gli insilati più asciutti che si insilano bene possono deteriorarsi rapidamente se esposti all’aria perché tendono ad essere più porosi nel silo rispetto agli insilati più umidi e mancano di quantità sufficienti di acidi organici (ad esempio acido acetico) con attività antimicotica per sopprimere la crescita di lieviti consumatori di lattato che innescano il deterioramento aerobio.
Tabella 1. Concentrazioni normali suggerite dei più comuni prodotti finali della fermentazione nei diversi insilati.
Il trattamento con un inoculo di batteri lattici omofermentanti può comportare un abbassamento del pH dell’insilato rispetto ad un insilato non trattato a causa della maggiore produzione di acido lattico e può essere più evidente nell’insilato di leguminose rispetto all’insilato di mais (Muck e Kung, 1997). Per le leguminose, la concentrazione di acido lattico può potenzialmente diminuire quando la SS dell’insilato scende al di sotto del 35-40% (vedi Figura 2) perché alcuni microrganismi come i clostridi possono prosperare in condizioni umide (<30-35% SS) e convertire l’acido lattico in acido butirrico. Tuttavia, questo non è il caso degli insilati di mais (Figura 1) perché il pH più basso di questa coltura, rispetto a quello delle leguminose, impedisce la crescita dei clostridi. Come detto in precedenza, non tutti gli insilati di leguminose umide vanno incontro a fermentazioni ad opera di clostridi, sebbene la probabilità che ciò avvenga sia maggiore quando il contenuto di umidità è superiore al 70%. Pertanto, i valori raccomandati per l’acido lattico per colture con meno del 30-35% di SS, come presentato nella Tabella 1, sono più alti rispetto a quanto osservato nella Figura 1. Diversi fattori possono essere responsabili di insilati con un pH più alto del normale.
Ad esempio, un’eccessivamente elevata capacità tampone (come negli insilati di leguminose con un contenuto proteico e di ceneri molto elevato) o una fermentazione ridotta (ad esempio, condizioni climatiche fredde) possono essere la causa di un pH più alto del previsto. Gli insilati inoculati con Lactobacillus buchneri spesso avranno da 0.1 a 0.2 unità di pH in più rispetto agli insilati non trattati (Kleinschmit e Kung, 2006) a causa della moderata conversione dell’acido lattico in acido acetico, 1,2-propandiolo (1,2PD) ed etanolo (Oude Elferink et al., 2001). Anche il deterioramento aerobio avviato dai lieviti che assimilano il lattato può essere responsabile di valori di pH più alti del normale negli insilati (McDonald et al., 1991). Ad esempio, Ranjit e Kung (2000) hanno riportato che il pH dell’insilato di mais è aumentato da 3.8 a 5 dopo l’esposizione all’aria per 3 giorni. Il deterioramento aerobio dell’insilato si accentua durante la stagione calda. Gli insilati di mais contenenti ammoniaca hanno solitamente un pH più alto del normale (~4.0) a causa dell’effetto alcalinizzante dell’ammoniaca aggiunta (Kung et al., 2000). Il metabolismo clostridico che converte l’acido lattico in acido butirrico spesso spiega perché alcuni insilati di leguminose ed erba con meno del 30-35% di SS hanno un pH più alto del normale. Di contro, è stato osservato un pH estremamente basso (<3–3.5) in alcuni insilati di mais ed erba molto umidi e potrebbe essere il risultato della reazione tra NO2 e acqua che lo converte in acido nitrico. Gli enterobatteri possono convertire il nitrato in nitrito, che in condizioni acide può essere convertito in NO e NO3 in un rapporto 2:1. In presenza di ossigeno, NO si converte rapidamente in NO2 e NOx (Pahlow et al., 2003).
Acidi volatili
L’acido acetico è il secondo acido che si trova alla più alta concentrazione nell’insilato, solitamente compresa tra l‘1 e il 3% della SS (Tabella 1). Analogamente all’acido lattico, la concentrazione di acido acetico è di solito inversamente proporzionale al contenuto di SS (figure 1-3). Quando l’acido acetico dell’insilato viene ingerito da un ruminante, può essere assorbito dal rumine e utilizzato per produrre energia o essere incorporato nel latte o nel grasso corporeo. Concentrazioni moderate di acido acetico nell’insilato possono essere utili perché inibiscono i lieviti, con conseguente miglioramento della stabilità quando l’insilato viene esposto all’aria. Infatti, gli insilati con concentrazioni molto basse di acido acetico possono essere instabili se entrano in contatto con l’aria. Concentrazioni leggermente più alte del normale di acido acetico (~ 3-4%) si ritrovano spesso negli insilati trattati con L. buchneri a causa della conversione dell’acido lattico in acido acetico come detto in precedenza. L’aumento dell’acido acetico porta ad un miglioramento della stabilità aerobia perché questo acido ha marcate peculiarità antimicotiche. Gli insilati trattati con ammoniaca anidra o in soluzione acquosa tendono ad avere concentrazioni più elevate di acido acetico rispetto agli insilati non trattati perché la fermentazione è prolungata dal suo tamponamento (Kung et al., 2000). Concentrazioni eccessivamente elevate di acido acetico (>4-6%) sono più spesso rilevate in insilati estremamente umidi (>70% di umidità) caratterizzati da fermentazioni indesiderate (ma naturali) dominate da enterobatteri, clostridi o batteri lattici eterofermentanti (McDonald et al., 1991). Anche gli insilati di leguminose con alto contenuto di ceneri (>15%) sono talvolta molto ricchi di acido acetico a causa di fermentazioni prolungate. Negli insilati di buona qualità, l’acido propionico di solito non è rilevabile (soprattutto negli insilati più asciutti) oppure è presente in concentrazioni molto basse (<0,1%).
I propionibatteri che convertono il glucosio e l’acido lattico in acido propionico e acetico sono stati ritrovati negli insilati, ma è dubbio che le popolazioni naturali possano prosperare nella maggior parte degli insilati. Elevate concentrazioni di acido propionico (>0.3-0.5%) si trovano più comunemente nelle fermentazioni operate da clostridi, probabilmente come esito della presenza di Clostridium propionicum. L’utilizzo di additivi contenenti acido propionico per migliorare la stabilità all’aria degli insilati può aumentare la sua concentrazione al momento dell’insilamento dello 0.15-0.30% circa (sulla SS) quando aggiunti in dose di 1 a 2 kg/t di foraggio umido (~35% SS), ma ciò dipende dalla percentuale dell’acido nell’additivo. Gli insilati trattati con L. buchneri a volte hanno concentrazioni più elevate di acido propionico perché 1,2PD può essere convertito in questo acido da Lactobacillus diolivorans (Krooneman et al., 2002). L’acido propionico ingerito viene assorbito dal rumine e convertito in glucosio dal fegato della vacca. L’acido butirrico non dovrebbe essere rilevabile negli insilati ben fermentati. La presenza di questo acido indica un’attività metabolica di clostridi, che porta ad importanti perdite di SS e ad uno scarso recupero di energia (Pahlow et al., 2003). Alcuni clostridi sono in grado di fermentare gli zuccheri in acido butirrico (saccarolitici), alcuni possono convertire l’acido lattico in acido butirrico e altre specie sono altamente proteolitiche. Oltre alla presenza di acido butirrico e di concentrazioni inferiori al normale di acido lattico, gli insilati contenenti clostridi sono spesso caratterizzati da un pH più alto del normale e da concentrazioni superiori al normale di acido acetico, NH3-N e proteine solubili (la figura 2 mostra alcuni di questi andamenti). Gli insilati con clostridi tendono anche ad avere elevate concentrazioni di fibra e bassa digeribilità della SS perché gran parte dei nutrienti solubili prontamente disponibili sono stati degradati (Mills e Kung, 2002). Livelli elevati di ammine biologiche (che variano a seconda del tipo di insilato; ad esempio, putrescina, cadaverina, tiramina e istamina) possono talvolta essere riscontrati negli insilati con clostridi, e queste possono influire negativamente sulle performance degli animali (Scherer et al., 2015), anche se questi composti non vengono analizzati di routine dai laboratori commerciali per gli alimenti. Le possibilità di una fermentazione da clostridi possono essere ridotte al minimo insilando foraggi con più del 30-35% di SS e inducendo una rapida produzione di acido lattico, perché i clostridi sono intolleranti sia all’elevata pressione osmotica che al basso pH. Anche il riempimento ritardato del silo o periodi di appassimento eccessivamente prolungati, con conseguente sostanziale riduzione degli zuccheri fermentescibili, possono provocare una fermentazione clostridica (Mills e Kung, 2002). Dovrebbe essere ridotta al minimo anche la contaminazione del foraggio dal terreno e dal letame durante la raccolta, perché questi sono la fonte primaria di spore di clostridi. L’ingestione di alte concentrazioni di acido butirrico (più di 50-100 g/giorno) può indurre chetosi nelle vacche in lattazione e poiché il valore energetico dell’insilato è basso, l’ingestione e la produzione possono risentirne (Oetzel, 2007). Paradossalmente, gli insilati contenenti acido butirrico tendono ad essere stabili se esposti all’aria perché questo acido ha forti caratteristiche antimicotiche. Sono stati fatti molti tentativi di correlare le concentrazioni di acidi dell’insilato con gli effetti sulle performance degli animali. Ad esempio, gli acidi totali e l’acido acetico vengono comunemente accusati di essere fattori in grado di influenzare negativamente l’ingestione nei ruminanti (Rook e Gill, 1990; Steen et al., 1998), ma i risultati ottenuti sono apparsi equivoci (Huhtanen et al., 2007; Krizsan et al., 2007). Eisner et al. (2006) hanno riportato che la concentrazione di acido acetico nell’insilato era correlata negativamente con l’ingestione quando l’insilato e i concentrati venivano somministrati separatamente, ma non quando l’insilato veniva somministrato agli animali come parte di una TMR. Si è ipotizzato che la diminuzione dell’ingestione con insilati ricchi di acido acetico possa essere dovuta a fattori organolettici o a fattori negativi non identificati associati a una scarsa fermentazione anziché solo alle elevate concentrazioni di acido acetico stesso. Huhtanen et al. (2007) hanno riportato che la concentrazione di acido totale e la concentrazione di acido propionico degli insilati erano correlate negativamente con l‘ingestione nelle vacche in lattazione. Hanno evidenziato che la correlazione negativa tra acido propionico e ingestione non era probabilmente dovuta direttamente all’acido stesso, ma ad altri effetti associati alla scarsa fermentazione che producono questo acido.
Alcoli ed esteri
L’etanolo è l’alcol più comunemente presente negli insilati. Può essere prodotto da una varietà di microrganismi (batteri lattici eterofermentanti, enterobatteri e lieviti) e di solito è basso negli insilati di pianta intera di mais e di leguminose (0.5-1,5%). L’etanolo ingerito viene convertito in acido acetico nel rumine o assorbito dalla parete ruminale (Bruning e Yokoyama, 1988) e successivamente convertito in grasso del latte o messo a disposizione per il metabolismo o la crescita corporea. Driehuis e van Wikselaar (2000) hanno riportato che in alcuni insilati di erba olandesi si possono trovare concentrazioni di etanolo fino al 5-6%. L’insilato di canna da zucchero non viene somministrato come alimento in Nord America, ma tale insilato può contenere oltre il 15% di etanolo sulla base della SS (Kung e Stanley, 1982; Daniel et al., 2013) perché un numero elevato di lieviti epifiti converte il saccarosio in etanolo. Elevate concentrazioni di etanolo negli insilati (> 3-4%) sono spesso associate alla presenza di numerosi lieviti e tali insilati di solito si deteriorano facilmente se esposti all’aria perché alcuni lieviti possono assimilare l’acido lattico in queste condizioni. Elevate quantità di etanolo sono associate anche ad importanti perdite di SS e se consumate in grandi quantità possono causare sapori sgradevoli nel latte. Sebbene nei ruminanti siano stati segnalati casi di avvelenamento da etanolo (Peixoto et al., 2011), è improbabile che ciò si verifichi con gli insilati più comunemente somministrati con la dieta, anche in presenza di elevate concentrazioni di etanolo. Una varietà di microrganismi può produrre 1,2PD, comprese alcune specie di clostridi e di lieviti (Suzuki e Onishi, 1968; Sanchez et al., 1987). Tuttavia, negli insilati classici, 1,2PD è molto probabilmente il prodotto del metabolismo dell’acido lattico da parte di L. buchneri. Le popolazioni naturali di L. buchneri possono a volte determinare basse concentrazioni di 1,2PD (0.1–0,3%) negli insilati, specialmente se conservati per periodi di tempo prolungati (>6–8 mesi).
Negli insilati inoculati con questo microrganismo, l’1,2PD di solito può essere rilevato solamente dopo 30-60 giorni di fermentazione perché la degradazione dell’acido lattico non è completamente attivata prima di questo tempo. Gli insilati inoculati con L. buchneri per migliorare la stabilità aerobia possono contenere tra lo 0.25 e l’1.5% di 1,2PD (ma sono state osservate concentrazioni fino al 3%). Il rilevamento di 1,2PD può essere utilizzato in linea generale per indicare se l’inoculazione con L. buchneri ha dominato la fermentazione, ma anche un microrganismo naturalmente presente, L. diolivorans, che a volte si ritrova nell’insilato può metabolizzare questo composto producendo propanolo e acido propionico (Krooneman et al. al., 2002). Quando viene ingerito dalla vacca, l’1,2PD può essere assorbito e convertito in glucosio nel fegato o convertito in acido propionico nel rumine. Sebbene nel ruminante l’ingestione di 1,2PD dell’insilato porti alla fine alla produzione di glucosio, probabilmente non giocherà un ruolo nella prevenzione della chetosi. La somministrazione di insilato contenente 1,2PD non dovrebbe essere utilizzata come terapia praticabile per la chetosi, perché le vacche probabilmente non riuscirebbero a consumare abbastanza 1,2PD per arrivare ad eguagliare il trattamento con bolo contenente da 250 a 400 g di 1,2PD comunemente raccomandato per la cura di questa patologia. Inoltre, una vacca che è già in chetosi è molto probabilmente già privata del mangime, e quindi l’ingestione di 1,2PD risulterebbe essere addirittura bassa. Una varietà di altri composti organici volatili (VOC) può essere riscontrata negli insilati (Krizsan et al., 2007; Daniel et al., 2013; Weiss, 2017) Recentemente, alcuni laboratori commerciali che effettuano test sui mangimi negli Stati Uniti hanno messo a punto dei test per determinare un certo numero di alcoli (ad es. metanolo, propanolo) ed esteri (acetato di etile, lattato di etile) negli insilati. Il metanolo libero non dovrebbe superare i 150 mg/kg come additivo alimentare nei mangimi per animali (Sellers, 2008), ma concentrazioni più elevate sono state rilevate in molti insilati (583-878 mg/kg negli insilati di erba; Weiss, 2017). È stato dimostrato che il metanolo viene convertito in metano nel rumine (Pol e Demeyer, 1988) ed è stato infuso nel rumine di manzi Holstein (210 g/giorno per manzi del peso di 399 kg) senza effetti negativi sull’ingestione o sulla digeribilità dell’OM e dell’amido del tratto totale (Winsco et al., 2011). Le concentrazioni di 1-propanolo appaiono basse nella maggior parte degli insilati, ma possono essere elevate negli insilati di mais trattati con L. buchneri (1.02% della SS; Hafner et al., 2014) e si aggirano intorno allo 0.44% della SS nei campioni di insilato di erba, con una concentrazione massima del 2.17% (Kristensen et al., 2010). Randby (2007) ha riferito che la somministrazione di 200 g di propanolo alle vacche ha ridotto il DMI dell’insilato ma non il DMI totale. Ha anche riferito che la somministrazione alimentare di propanolo ha diminuito la percentuale di grasso e di proteine del latte, nonché l’ECM, ma non la produzione totale di latte. Inoltre, ha scoperto che la somministrazione di propanolo modificava le proprietà organolettiche del latte della sera ma non quelle del latte del mattino. Di contro, la somministrazione di 300-400 g di propanolo/giorno alle vacche non ha avuto effetti sull’ingestione o sulla produzione o composizione del latte (Raun e Kristensen, 2011). Weiss (2017) ha riportato concentrazioni di lattato di etile fino a 1.305 mg/kg e di acetato di etile fino a 1.109 mg/kg nell’insilato di mais. È stato visto che il lattato di etile ha una debole correlazione negativa con il DMI nelle capre (Gerlach et al., 2013), ma mancano chiari collegamenti con gli effetti sull’assunzione nelle vacche da latte in lattazione.
Rapporto acido lattico:acido acetico
Il rapporto tra acido lattico e acido acetico è comunemente usato come indicatore qualitativo della fermentazione. Le buone fermentazioni degli insilati di solito hanno un rapporto tra questi acidi da 2.5 a 3.0. Negli insilati trattati con un inoculo di batteri lattici omofermentanti, in particolare negli insilati di leguminose, si può riscontrare un rapporto leggermente più alto tra acido lattico e acido acetico (Muck e Kung, 1997) perché questi batteri producono solamente acido lattico. Al contrario, gli insilati trattati con L. buchneri avranno concentrazioni maggiori di acido acetico e un rapporto inferiore tra acido lattico e acido acetico rispetto agli insilati non trattati (Kleinschmit e Kung, 2006) a causa del metabolismo di una parte dell’acido lattico in acido acetico; questo non deve essere preso come indicatore di una cattiva fermentazione. Il moderato aumento della produzione di acido acetico da parte di L. buchneri rientra nei limiti normali e la somministrazione di insilati trattati con questo inoculo non ha influenzato negativamente l’ingestione (Schmidt et al., 2017). Insilati con tenori molto elevati di acido lattico:acido acetico a volte possono essere più instabili in condizioni di aerobiosi rispetto agli insilati con rapporti normali perché basse concentrazioni di acido acetico potrebbero non essere sufficienti per inibire i lieviti che consumano il lattato. Rapporti acido lattico:acido acetico inferiori a 1 sono solitamente un’indicazione di fermentazioni anomale.
N solubile e N ammoniacale
I processi proteolitici vegetali e microbici portano a cambiamenti nei composti azotati presenti negli insilati. In breve, la fermentazione determina un aumento dell’azoto solubile [tra il 55 e il 60% dell’azoto totale (dati non mostrati) e dell’NH3-N (solitamente meno del 10-15% dell’azoto totale; Figure 1-3)]. In generale, gli insilati con elevata umidità hanno concentrazioni più alte di N solubile e NH3-N rispetto agli insilati più secchi a causa della fermentazione complessivamente più marcata nei primi. Livelli più alti del normale di N solubile e di NH3-N negli insilati di leguminose più umidi sono solitamente il risultato dell’attività proteolitica dei clostridi (figura 1).
Popolazione microbica
La conta dei lieviti e delle muffe negli insilati può essere utile perché, come accennato in precedenza, un numero elevato di lieviti è solitamente associato a concentrazioni elevate di etanolo e il loro numero è spesso inversamente proporzionale alla stabilità aerobica degli insilati. Ciò è particolarmente vero nelle colture a base di mais. Ad esempio, Kung et al. (1998) hanno pubblicato la correlazione negativa y = 315.4 – 45.7x, r = 0.79, dove x è il log10 del numero totale di lieviti nell’insilato di mais e y sono le ore previste di stabilità in aerobiosi (definite come aumento >2°C della temperatura di una massa di insilato dopo esposizione all’aria). Questa equazione prevede che la stabilità aerobica sia zero quando ci sono ≥ 6 log10 ufc di lieviti/g di insilato di mais umido per i campioni in quello studio; quindi, un buon insilato dovrebbe contenere meno di questo numero di lieviti per grammo di insilato umido. Conoscere il numero di lieviti sulla coltura fresca è di poco valore perché i dati provenienti dal laboratorio dell’autore senior (dati non mostrati) non hanno prodotto alcuna correlazione tra il numero di lieviti totali su piante di mais intere appena tritate e il numero finale di lieviti nel risultante insilato (non trattato). Ciò non sorprende perché le condizioni di insilamento e i vari trattamenti possono alterare la fermentazione che ne deriva. Sebbene prove aneddotiche sul campo suggeriscano che un elevato numero di lieviti nell’insilato sia associato a scarse performance degli animali, non è stato stabilito un collegamento esatto di causa ed effetto. Santos et al. (2015) hanno isolato un lievito saprofita da HMC, che una volta aggiunto al fluido ruminale ha diminuito la digeribilità della fibra in vitro, ma non è stato dimostrato lo stesso avvenimento in vivo. Windle e Kung (2013) hanno riportato che le manze mangiavano di meno quando veniva offerta una TMR deteriorata (con insilato) contenente un elevato numero di lieviti (7.82 log ufc/g di peso fresco) rispetto ad una TMR fresca (5.03 log ufc/g di peso fresco). In quello studio, un numero elevato di lieviti è stato individuato anche nel fluido ruminale di quelle manze alimentate con TMR deteriorata. Non è chiaro se i potenziali effetti negativi di una somministrazione alimentare di insilati o di TMR con livelli elevati di lieviti siano dovuti ad un effetto diretto dei lieviti stessi, a cambiamenti nelle proprietà organolettiche dell’insilato, alla produzione di composti tossici o ad una combinazione di più fattori. Il numero totale di muffe nell’insilato non deve essere utilizzato come indicatore della presenza di micotossine (Gotlieb, 2016), ma numeri elevati (>6 log10 ufc/g di insilato umido) sono solitamente associati ad insilati deteriorati dall’esposizione all’aria.
Hoffman e Ocker (1997) hanno evidenziato una correlazione negativa tra presenza di muffe e produzione di latte partendo da un insilato di HMC che era stato rimosso da un silo tutto in una volta e somministrato come alimento per un periodo di 14 giorni. Occorre prestare attenzione quando si interpretano i numeri riguardanti lieviti e muffe negli insilati per diversi motivi. In primo luogo, i laboratori di analisi elencano il numero totale di lieviti ma non distinguono tra quelli che sono assimilatori di lattato e quelli che non lo sono. In secondo luogo, il lievito può essere in grado di crescere su agar selettivo durante la conta, ma ciò non riflette necessariamente le sue capacità metaboliche nell’insilato. Pertanto, un insilato con una quantità moderata di lieviti può ancora essere relativamente stabile dal punto di vista aerobico. In terzo luogo, specialmente negli insilati di mais, Acetobacter può dare inizio al deterioramento aerobio (Spoelstra et al., 1988), e quindi gli insilati con basso numero di lieviti possono essere instabili in condizioni di aerobiosi. Inoltre, gli insilati che sono andati incontro ad un diffuso deterioramento possono avere un numero molto basso di lieviti e muffe perché questi organismi sono morti a causa della mancanza di substrato. Infine, il numero di lieviti e muffe può aumentare notevolmente dal momento del campionamento all’arrivo in laboratorio, soprattutto nella stagione calda. L’analisi per i clostridi nell’insilato è discutibile perché basta un accumulo di acido butirrico per confermare la loro presenza.
Caratteristiche organolettiche delle fermentazioni dell’insilato
L’esecuzione di un’analisi completa dei profili chimici e nutrizionali per un campione di insilato può essere costosa. Dall’aspetto e dall’odore dell’insilato possiamo trarre alcuni indizi su ciò che è accaduto durante il processo di fermentazione.
Odori provenienti dall’insilato
Gli insilati ben fermentati non dovrebbero avere un odore forte e particolare perché l’acido lattico, il principale acido organico della fermentazione, è quasi inodore. Tuttavia, la maggior parte degli insilati tende ad avere un lieve odore di aceto (acido acetico) perché questo è il secondo acido prodotto nella più alta concentrazione dopo l’acido lattico ed è molto volatile. Dopo aver annusato degli insilati contenenti concentrazioni molto elevate di acido acetico rimane spesso una sensazione di bruciore agli occhi e al naso. Oltre all’odore di aceto, l’insilato umido contenente un quantitativo eccessivo di acido acetico presenta anche un colore giallo, specialmente sul fondo del silo perché l’effetto del compattamento andrà ad aumentare ulteriormente il contenuto di umidità in questa zona. Gli insilati con un odore fruttato e dolce vengono erroneamente associati ad un alimento ben fermentato e stabile. In realtà, questi odori sono generalmente dovuti ad elevate concentrazioni di alcol (etanolo) prodotte principalmente dai lieviti ma anche da molti batteri (McDonald et al., 1991). L’etanolo è considerato uno dei VOC più significativi rilasciati dagli insilati di mais nell’atmosfera (Hafner et al., 2013). Inoltre, gli alcoli possono reagire con gli acidi nell’insilato, producendo esteri che si aggiungono all’aroma fruttato. È stato descritto che alcuni insilati di mais ben fermentati e stabili senza segni di contaminazione o di deterioramento da funghi odorano di smalto per unghie o di solvente per unghie con sentori simili all’acetone. La limitata ricerca disponibile indica una correlazione di questi odori con i livelli di esteri etilici e propilici di lattato e acetato ed eventualmente di acido fenil acetico. I batteri si ritrovano nel terreno piuttosto che nel materiale vegetale fresco e il loro numero di spore può aumentare se viene utilizzato come fertilizzante il letame. I bacilli anaerobi facoltativi possono utilizzare diversi zuccheri, che convertono in acidi organici, etanolo, 2,3-butandiolo e glicerolo (Pahlow et al., 2003). I batteri sono uno dei primi gruppi di microrganismi a svilupparsi negli insilati dopo che il processo di deterioramento aerobio è stato avviato dai lieviti. Questa tipologia di materiale va incontro ad una diversa forma di deterioramento aerobio, che comporta un forte surriscaldamento, guidato dalla crescita di bacilli termogenici. Un odore terroso negli insilati è un segno della crescita batterica e l’insilato probabilmente presenterà un pH elevato. Gli insilati che sono aerobicamente instabili possono presentare anche un odore di stantio o di muffa e può essere visibile la crescita della muffa stessa. L’insilato ammuffito dovrebbe essere scartato perché potrebbe essere contaminato da micotossine, che possono causare seri problemi di produzione, salute e fertilità (Korosteleva et al., 2009) oltre ad avere di per sé un valore nutrizionale più basso a causa della previa crescita di lieviti (Santos et al., 2015).
I clostridi saccarolitici (Clostridium tyrobutyricum e Clostridium butyricum) si trovano solitamente negli insilati e utilizzano zuccheri solubili o acidi organici (lattici) per produrre acido acetico e acido butirrico, che ha un forte odore di burro rancido. Altre specie di clostridi (ad es. Clostridium sporogenes) possono fermentare sia i carboidrati che le proteine, con queste ultime che vengono convertite in ammoniaca e ammine biogeniche. L’eccessiva proteolisi può conferire un odore di putrido, di pesce o simile all’ammoniaca. Gli insilati contenenti clostridi hanno spesso un aspetto viscido, verde oliva. Inoltre, questi insilati hanno un basso livello energetico e proteine altamente solubili e per questo l’ingestione alimentare risulterà essere bassa (Muck, 2011); quindi, spingere per una maggiore ingestione utilizzando agenti mascheranti il sapore e l‘aroma può andare ad aumentare i problemi di produzione, salute e fertilità. Il fieno di erba medica insilato con un elevato contenuto di SS (in particolare quelli con >50-55% di SS) può avere un odore di tabacco che è associato a cambiamenti nelle caratteristiche delle frazioni proteiche, con produzione di proteine danneggiate dal calore come risultato della reazione di Maillard (Goering et al., 1973). In questa reazione, le proteine si legano con gli zuccheri in presenza di elevata temperatura. L‘eccesso di ossigeno intrappolato nella massa foraggera stimola la respirazione delle piante e l’attività metabolica dei microrganismi aerobi, portando alla produzione di calore. Nelle prime fasi di questo processo l’odore è più simile a quello del tabacco dolce, che è meno preoccupante. Questa tipologia di alimento presenta un aspetto secco e una colorazione brunastra e dovrebbe essere testato per le ADIN per verificare il livello di proteine legate o meno disponibili, nel caso siano necessarie correzioni della dieta. Gli insilati estremamente danneggiati dal calore possono effettivamente avere un odore di bruciato e apparire di colore nero. Vale la pena notare che, sebbene la diminuzione della biodisponibilità di proteine e AA siano al centro delle reazioni di Maillard, le perdite di energia (TDN) sono forse più importanti (Coblentz et al., 2011).
Temperature dell’insilato
La produzione di calore è un evento normale durante la fermentazione dell’insilato. Se l’insilato è ben compattato e sigillato immediatamente, la temperatura media della massa di foraggio non dovrebbe aumentare di più di 5-8°C circa al di sopra della temperatura ambiente al momento del caricamento. Tuttavia, le temperature negli strati più superficiali (5-10 cm della parte superiore) di una massa foraggera possono raggiungere anche i 45-60°C, soprattutto se lasciata durante la notte con clima caldo per diversi giorni a causa di guasti alle attrezzature o di ritardi nel compattamento in seguito a maltempo. Queste temperature elevate sono il risultato di un quantitativo eccessivo di aria che rimane intrappolata nella massa foraggera e che porta all’ossidazione da parte di microrganismi aerobi. È essenziale che queste temperature diminuiscano rapidamente man mano che un ulteriore compattamento della massa garantisce la rimozione dell’aria ed inizia la fermentazione. Temperature elevate prolungate (superiori a 45-50°C) possono portare al danneggiamento da calore delle proteine e ad aumenti delle ADIN come detto in precedenza. Questi intervalli di temperatura possono essere dannosi anche per molti batteri lattici che sono necessari per ottenere una fermentazione di successo. Pertanto, il foraggio deve essere tagliato adeguatamente, compattato rapidamente e sigillato ermeticamente il prima possibile per rimuovere e mantenere l’aria fuori dalla massa del foraggio. Quando la fase attiva della fermentazione è completa, le temperature nel cuore del silo spesso diminuiscono lentamente fino a 25-30°C. I piccoli silos (comprese le silo-balle e le grandi rotoballe) dovrebbero raffreddarsi più rapidamente rispetto ai silos più grandi. Il calore trattenuto dovrebbe raramente superare i 35°C, soprattutto dopo diversi mesi di conservazione. Le temperature al cuore dell’insilato rimangono spesso elevate per periodi di tempo prolungati in silos di grandi dimensioni perché la grande massa di foraggio funge da isolante, determinando una dissipazione del calore molto lenta. In alcuni casi, gli insilati possono essere relativamente caldi (>30–35°C) anche dopo 4-6 settimane (o più) nel silo. Questo risultato può essere più comune negli insilati di colture con bassi livelli di umidità (>40–45% SS) e mal compattati. In questi casi, il calore prolungato può essere il risultato di una fermentazione lenta o di un’ossidazione aerobia. Gli insilati secchi tendono ad essere più porosi quando compattati e la lenta fermentazione prolunga l’attività microbica totale e non è in grado di sopprimere il metabolismo di lieviti e muffe perché vengono prodotte basse quantità di acidi antifungini e il pH è piuttosto elevato. Se il silo in questione è quello da cui viene prelevato l’alimento, ciò può aggravare il problema perché il fronte del silo viene costantemente smosso, consentendo all’aria di penetrare nella massa. La riduzione della lunghezza del taglio per i foraggi ad elevato tenore di SS e la lavorazione meccanica dell’insilato di mais possono essere giustificate in quanto queste pratiche aiutano ad aumentare la densità del compattamento. Le temperature elevate all’interno del silo, specialmente dopo mesi di fermentazione e durante il desilamento, sono molto probabilmente il risultato di un deterioramento aerobio. La penetrazione dell’aria nella massa dell’insilato determina la crescita di lieviti che assimilano il lattato e un aumento della temperatura dell’insilato, seguito da un aumento del pH. Quest’ultimo alla fine si traduce in una crescita di batteri e muffe opportuniste che prosperano grazie all’ossigeno e provocano un aumento del riscaldamento e del deterioramento.
In alcuni casi, le temperature nei fronti dell’insilato possono superare i 50°C. Nelle capre, Gerlach et al. (2013) hanno riportato che la variazione della temperatura dell’insilato di mais rispetto alla temperatura ambiente era correlata negativamente (r = -0,835, P <0.0001) con il DMI. Durante la stagione fredda, viene spesso rilasciato vapore durante la fase di desilamento dal fronte di grandi silos a causa della differenza tra il calore trattenuto e la temperatura ambiente. La presenza di vapore non sempre significa che l’insilato si sta deteriorando, soprattutto nei mesi invernali. I segni che indicano che l’insilato si sta deteriorando a causa dell’aria includono la misurazione di temperature superiori a 40°C nei 10-20 cm dietro il fronte del silo durante il desilamento, l’emissione di calore nella corsia di alimentazione, la presenza di muffa visibile, la mancanza di un odore pungente o dolce nell’insilato o la presenza di odore di muffa o di stantio. Se si dispone di un misuratore di pH, anche un odore di muffa associato a un pH elevato può essere un buon indicatore del deterioramento aerobio dell’insilato. Il deterioramento aerobio degli insilati è ovviamente più comune durante i periodi più caldi. L’insilato che fa riscaldare rapidamente la TMR nella corsia di alimentazione molto probabilmente ha un’elevata concentrazione di lieviti che stanno causando un ulteriore deterioramento. È possibile utilizzare sonde relativamente economiche per monitorare le temperature nei silos a platea e a trincea, ma è necessario prestare estrema attenzione a non mettersi in pericolo quando si effettuano le misurazioni della temperatura.
Effetti del tempo di insilamento sulla fermentazione dell’insilato
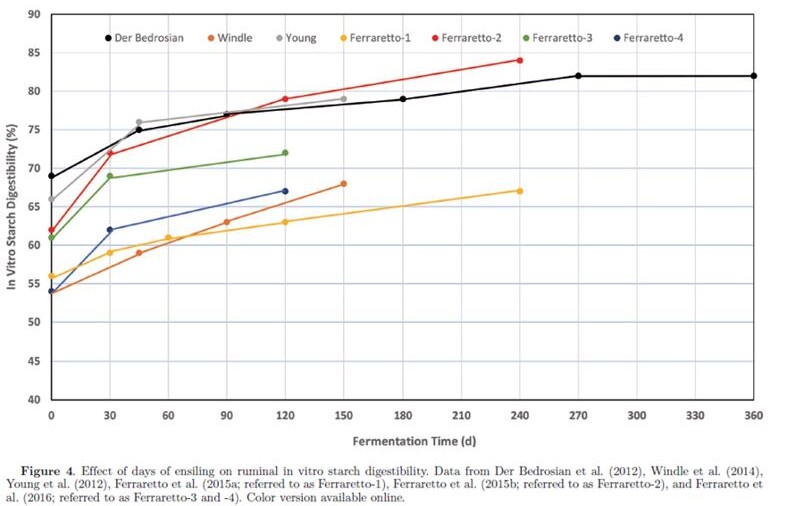
Complessivamente, si ritiene che la fase fermentativa del processo di insilamento duri dai 7 ai 45 giorni (Pahlow et al., 2003). Tuttavia, recenti ricerche indicano che la fermentazione continua per un tempo molto più lungo nell’insilato di pianta intera di mais (WPCS; Der Bedrosian et al., 2012; Windle et al., 2014) e nell’insilato di HMC (Kung et al., 2014). La diminuzione del pH dell’insilato è generalmente più rapida nel mais a pianta intera rispetto all’insilato di leguminose perché quest’ultimo ha una maggiore capacità tampone. Negli insilati di leguminose, la diminuzione del pH dell’insilato è più rapida quando ci sono foraggi con bassa SS (<30%) rispetto a foraggi con alta SS (>40%) perché nei primi è disponibile più acqua metabolica. Windel et al. (2014) e Der Bedrosian et al. (2012) hanno riportato un calo del pH nel WPCS durante il periodo di conservazione fino a 150 giorni (tempi di fermentazione di 45, 90 e 150 giorni) e anche dopo 180 giorni (tempi di fermentazione di 45, 90, 180, 270 e 365 giorni). Inoltre, entrambi i report di ricerca hanno notato un graduale aumento delle concentrazioni di lattato e acetato con il progredire della durata della conservazione. Risultati simili sono stati riportati negli studi sull’HMC. L’abbassamento del pH è stato segnalato da Baron et al. (1986) e da Wardynski et al. (1993) quando l’HMC è stato insilato per un massimo di 90 o 165 giorni, rispettivamente, in relazione all’aumento delle concentrazioni di lattato e acetato nel corso dello stoccaggio. Analogamente, una graduale diminuzione del pH è stata segnalata da 120 a 365 giorni di conservazione da Stock et al. (1991). La diminuzione del pH durante lunghi periodi di conservazione è in accordo con l’attività batterica nell’HMC quando il processo di fermentazione è stato valutato in un lasso di tempo di 200 giorni (Burmeister et al., 1966; Bothast et al., 1975). Hoffmann et al. (2011) hanno riportato che l’insilamento di HMC per 240 giorni ha ridotto le subunità proteiche di zeina che formano un reticolo con i granuli di amido e hanno ipotizzato che la matrice amido-proteica è stata degradata dall’attività proteolitica durante un lungo periodo di insilamento. Ciò potrebbe spiegare le segnalazioni di una maggiore digeribilità ruminale in situ dell’amido con l’insilamento dei chicchi di mais raccolti a metà stadio della linea lattea (Philippeau e Michalet-Doreau, 1998) o una maggiore degradabilità ruminale in situ della SS per HMC con contenuto più basso di SS e maggiore durata della fermentazione dell’insilato (Benton et al., 2005). Inoltre, nello studio di Hoffman et al. (2011), la concentrazione di N aumentava quando le subunità proteiche di zeina nell’HMC diminuivano. Maggiori concentrazioni di N solubile sono state osservate quando l’HMC è stato insilato fino a 90, 165 o 365 giorni negli esperimenti condotti, rispettivamente, da Baron et al. (1986), Wardyinsky et al. (1993) e Benton et al. (2005). Analogamente, il prolungamento del di tempo insilamento ha aumentato le concentrazioni di azoto ammoniacale e CP solubile negli studi su WPCS (Der Bedrosian et al., 2012; Windle et al., 2014; Ferraretto et al., 2015a, b; Ferraretto et al., 2016). Gli effetti del tempo di insilamento sulla digeribilità ruminale in vitro dell’amido (ivSD) del WPCS sono riassunti nella Figura 4. Sebbene siano state osservate alcune variazioni nella risposta tra le prove, generalmente è stato osservato un aumento di circa 5-10 unità percentuali nella ivSD nell’arco di una fase di fermentazione di 45 giorni (Pahlow et al., 2003) a cui ha fatto seguito un aumento simile tra i 45 e i 120 giorni di insilamento.
La massima ivSD del WPCS potrebbe non essere raggiunta prima di circa 9 mesi di conservazione. Risultati simili sono stati riportati per HMC (Kung et al., 2014), con un aumento di 8 unità percentuali di ivSD da 0 a 70 giorni di insilamento seguito da un altro aumento di 8 unità percentuali dopo 140 giorni. I coefficienti di correlazione tra ivSD e azoto ammoniacale o CP solubile erano, rispettivamente, 0.82 e 0.70 in WPCS (Ferraretto et al., 2015b) e 0.78 e 0.74 nell’HMC (Ferraretto et al., 2014). I principali meccanismi (solubilizzazione e proteolisi) responsabili della rottura delle molecole proteiche di zeina legate ai granuli di amido si verificano in condizioni acide, il che suggerisce che le continue alterazioni del profilo di fermentazione con il progredire del tempo di conservazione possono influenzare direttamente l’ivSD. In primo luogo, le molecole proteiche di zeina sono solubili in acido acetico e lattico (Lawton, 2002), i due principali prodotti finali della fermentazione dell’insilato (Muck, 2010). Inoltre, l’attività proteolitica, sia da parte di proteasi microbiche che vegetali, si verifica in modo più diffuso durante il processo di fermentazione anaerobia (Baron et al., 1986). La fase anaerobia è caratterizzata da una drastica diminuzione del pH (Muck, 2010), che favorisce l’attività delle proteasi vegetali specifiche dell’endosperma dei chicchi di cereali (Simpson, 2001) anche se solitamente l‘attività delle proteasi vegetali si riduce con pH basso (Muck, 1988). Junges et al. (2017) hanno valutato il contributo delle fonti proteolitiche alla solubilizzazione delle proteine nel mais reidratato insilato per 90 giorni. Questi autori hanno riportato che le proteasi batteriche sono responsabili di un aumento del 60% delle concentrazioni di CP solubile, seguite dagli enzimi e dai funghi della cariosside (30%) e dai prodotti finali della fermentazione (5% ciascuno). Gli studi che valutano gli effetti del tempo di insilamento sulla digeribilità dell’NDF ruminale in vitro (ivNDFD) nel WPCS sono riassunti nella Tabella 2. Cherney et al. (2007) e Der Bedrosian et al. (2012) hanno osservato riduzioni della ivNDFD di 6 e 2 unità percentuali rispettivamente dopo 30 e 45 giorni di insilamento. Si pensa che questi cambiamenti possano essere correlati alla solubilizzazione della fibra all’inizio dell’insilamento. Inoltre, è stato osservato un abbassamento inferiore ad una unità percentuale di ivNDFD per 45 giorni rispetto a 150 giorni di insilamento (Young et al., 2012). Nessun effetto è stato osservato negli studi di Hunt et al. (1993), Sanderson (1993), o Ferraretto et al. (2015b). Nel complesso, questi risultati sottolineano che l’ivNDFD è solo minimamente influenzata dall’insilamento e che la selezione e la classificazione degli ibridi basata sulla ivNDFD di campioni non insilati è valida (Lauer et al., 2013).
Potenziali problematiche ambientali causate dai prodotti finali della fermentazione degli insilati
In determinate condizioni, gli insilati possono contenere composti potenzialmente tossici come nitrati, acido prussico e micotossine. Review e report condotti in precedenza hanno trattato in modo approfondito gli argomenti relativi a muffe e micotossine negli insilati (Mahanna e Chase, 2003; Alonso et al., 2013), ai nitrati, ai gas che fuoriescono dal silo durante la somministrazione di insilati al bestiame (Mahanna e Chase, 2003; Rasby et al., 2007) e hanno espresso preoccupazioni relative all’acido prussico (Collins e Hannaway, 2003; Whittier, 2011). Questa sezione si concentra sulla problematica di tipo ambientale relativamente nuova che gira intorno ai VOC emessi dagli insilati. La maggior parte delle ricerche sulla qualità dell’aria in azienda si è concentrata sugli odori, sull’ammoniaca o sul materiale particolato (Hafner et al., 2013). Tuttavia, le emissioni di VOC dall’insilato sono un fattore che contribuisce significativamente alla scarsa qualità dell’aria nelle regioni con elevate concentrazioni di allevamenti come la San Joaquin Valley nella California centrale (Howard et al., 2010). In futuro, la misurazione dei VOC negli insilati diventerà sempre più importante.
Tabella 2. Effetti del tempo di insilamento sulla digeribilità ruminale in vitro della NDF (% NDF) dell’insilato di pianta intera di mais
Gli insilati emettono notevoli quantità di VOC, che sono precursori dell’ozono troposferico (Bonifacio et al., 2017). In presenza di luce solare, i VOC emessi nell’atmosfera reagiscono con gli ossidi di azoto e formano ozono a livello del suolo, che è regolamentato dalla US Environmental Protection Agency (USEPA, 2016). I 2 principali fattori che contribuiscono alle emissioni di VOC sono le TMR nelle mangiatoie o nelle corsie di alimentazione, seguiti dai sistemi di stoccaggio dell’insilato (Chung et al., 2010). L’insilato emette più di 50 VOC (Howard et al., 2010) che possono essere raggruppati come acidi, alcoli, chetoni, esteri e aldeidi. Una review di Hafner et al. (2013) ha individuato i VOC più importanti derivanti dall’insilato di mais. Gli alcoli costituiscono la massa più grande di VOC, con l’etanolo come alcol predominante. Escludendo gli acidi, l’etanolo costituisce più della metà della massa media di VOC emessa dall’insilato di mais. Quando l’emissione è elevata e tutti i VOC sono quasi esauriti, allora gli acidi (come l’acido acetico) possono diventare importanti. Le aldeidi e gli esteri sono più volatili degli acidi o degli alcoli e possono essere importanti quando il tempo di esposizione dell’insilato all’aria è breve. Le pratiche di gestione possono avere un effetto sostanziale sulle concentrazioni di VOC. Un controllo efficace dei VOC provenienti dall’insilato comporterebbe riduzioni sia della loro produzione che delle loro emissioni. Per una migliore gestione è necessaria una maggiore comprensione del processo di emissione dei VOC in azienda e, ad oggi, buona parte della ricerca si è concentrata sullo sviluppo e sull’utilizzo di additivi e di inoculi per insilati. La maggior parte dei VOC è probabilmente prodotta direttamente o indirettamente da batteri lattici eterofermentanti o da microrganismi indesiderati come enterobatteri, clostridi o lieviti (Hafner et al., 2013). Gli additivi per insilati possono inibire direttamente l’attività di specifici gruppi microbici o creare condizioni ambientali che li inibiscono. Tuttavia, potrebbe essere difficile ridurre la produzione di tutti i VOC, o anche di alcuni, senza aumentare la produzione di altri (Driehuis e van Wikselaar, 2000; Hafner et al., 2013). Gli studi che hanno valutato gli inoculi batterici sull’insilato di mais hanno mostrato risultati discordanti.
Alcuni studi come Filya e Sucu (2010) hanno rilevato che Lactobacillus plantarum e L. buchneri, da soli o in combinazione con altri batteri, riducono la produzione di etanolo nell’insilato di mais dal 30 al 40%. Al contrario, Contreras-Govea et al. (2011) non hanno osservato alcun effetto dell’inoculazione con L. plantarum e con altri batteri lattici sul contenuto di etanolo nell’insilato di mais. Infine, alcuni studi come Steidlová e Kalac (2003) hanno effettivamente misurato aumenti fino a 3 volte della concentrazione di etanolo nell’insilato di mais in risposta all’inoculazione con L. plantarum o L. buchneri. Una meta-analisi ha mostrato che l’inoculazione con L. buchneri non ha avuto un’influenza costante sull’etanolo nell’insilato di mais (Kleinschmit e Kung, 2006). Per gli insilati di mais, gli inoculi batterici non sembrerebbero determinare riduzioni costanti di etanolo (Hafner et al., 2014, 2015). Sebbene meno studiati, gli additivi chimici progettati per inibire lo sviluppo di funghi o batteri indesiderati promettono di ridurre l’etanolo nell’insilato (Hafner et al., 2014). L’acido propionico sembrerebbe non avere alcun effetto sulla produzione di etanolo dall’insilato di mais (Kleinschmit et al., 2005), ma una miscela 1:1 di sorbato di potassio ed EDTA sarebbe in grado di diminuire l’etanolo dell’80% (Kleinschmit et al., 2005). Analogamente, Teller et al. (2012) hanno osservato una riduzione dal 20 al 90% di etanolo con il sorbato di potassio aggiunto all’insilato di mais. Tuttavia, Knicky e Sporndly (2011) hanno osservato che una miscela di sorbato di potassio, benzoato di sodio e nitrito di sodio è riuscita a ridurre l’etanolo nell’insilato di legumi e di erba, ma non nell’insilato di erba con elevata SS o nell’insilato di mais. In futuro, una miscela di inoculi omofermentanti per ridurre al minimo l’acido acetico e l’etanolo insieme ad un additivo chimico per sopprimere i lieviti potrebbe rappresentare un approccio fruttuoso per ridurre i VOC (Hafner et al., 2015). Qualunque strategia venga sviluppata, deve essere compatibile con pratiche ben accettate capaci di ridurre al minimo le perdite durante lo stoccaggio dell’insilato. Un modello basato sui processi per prevedere le emissioni di VOC è stato sviluppato da Bonifacio et al. (2017) e inserito nell’Integrated Farm System Model (versione 4.3; Rotz et al., 2016). Le prestazioni del modello sono state valutate utilizzando misure delle emissioni di etanolo e metanolo da sili a platea convenzionali, da silo balle, dalla TMR e dall’insilato di mais sfuso. Le simulazioni del modello hanno mostrato che le emissioni maggiori di VOC da insilato provenivano dalla TMR che si trova nelle mangiatoie o nelle corsie di alimentazione e non dai fronti esposti dell’insilato. Sulla base di questo modello, gli sforzi di mitigazione dovrebbero concentrarsi sulle emissioni di VOC associate all’alimentazione degli animali. Per la simulazione in allevamento, le emissioni di VOC sono state ridotte all’incirca del 30% quando le vacche erano stabulate al chiuso invece che in un lotto all’aperto e del 23% quando l’alimento veniva fornito 4 volte rispetto a una volta al giorno. Anche se questo modello indica che l’alimentazione rappresenta la maggiore preoccupazione per le emissioni di VOC, è importante ridurre anche la superficie esposta dell’insilato durante lo stoccaggio. Ad esempio, l’utilizzo di silo balle ha ridotto le emissioni dal fronte dell’insilato del 90% se paragonato ai silos a platea.
Conclusioni
I componenti chimici, microbici e organolettici dell’insilato possono essere utilizzati per spiegare la tipologia di fermentazione che è avvenuta e possono giustificare o prevedere le scarse performance degli animali quando l’insilato viene somministrato ai ruminanti nel caso in cui questi componenti si discostino molto dalla regola. Sempre più spesso, il rilevamento di VOC provenienti dagli insilati, unitamente agli odori, all’ammoniaca e al particolato, costituirà un problema di carattere ambientale per le aziende agricole. È necessario definire un utilizzo maggiormente predittivo dei dati chimici ed individuare altri fattori misurabili che potrebbero essere utilizzati per spiegare meglio le performance degli animali.